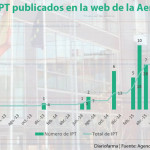
La Comisión Interministerial de Precios de los Medicamentos (CIPM) ha propuesto en su última reunión celebrada el 24 de julio la financiación total o parcial de 12 nuevos fármacos, cuatro de ellos son medicamentos huérfanos para el tratamiento de enfermedades raras. En esta reunión, una de las que más autorizaciones ha registrado desde que se constituyó el organismo, también se han aprobado también 5 nuevas indicaciones de cuatro medicamentos adicionales, ya autorizados y financiados previamente en otras indicaciones.
En la docena de medicamentos autorizados se incluye Vitrakvi (larotrectinib) indicado para su uso en monoterapia para el tratamiento de pacientes adultos y pediátricos con tumores sólidos que presentan una fusión del gen del receptor de tirosina quinasa neurotrófico.
También ha sido aprobado Livtencity H (maribavir), dirigido al tratamiento de la infección y/o enfermedad por citomegalovirus (C MV) que es refractaria (con o sin resistencia) a uno o más tratamientos previos, incluyendo ganciclovir, valganciclovir, cidofovir o foscarnet en pacientes adultos que se han sometido a un trasplante de células madre hematopoyéticas (TC MH) o a un trasplante de órganos sólidos (TOS).
Otro de los medicamentos aprobados es Amvuttra H (vutrisirán), para el tratamiento de la amiloidosis hereditaria por transtiretina (ATTRh) en pacientes adultos con polineuropatía en estadio 1 o 2. Así como Vabysmo (faricimab), para el tratamiento de pacientes adultos con: degeneración macular asociada a la edad neovascular (exudativa) (DMAEn); alteración visual debida a edema macular diabético (EMD).
También ha recibido aprobación Tezspire (tezepelumab), para el tratamiento de mantenimiento adicional en adultos y adolescentes a partir de 12 años con asma grave que no están adecuadamente controlados a pesar de la administración de corticosteroides inhalados a dosis altas en combinación con otro medicamento para el tratamiento de mantenimiento.
Nilemdo (ácido bempedoico): indicado en adultos con hipercolesterolemia primaria (familiar heterocigótica y no familiar) o dislipidemia mixta, como adyuvante a la dieta: o en combinación con una estatina o una estatina con otros tratamientos para la reducción de los lípidos en pacientes que no puedan alcanzar sus objetivos d e C -LDL con la dosis máxima tolerada de una estatina.
Este fármaco también se indica en monoterapia o en combinación con otros tratamientos para la reducción de los lípidos en pacientes intolerantes a las estatinas o en los que esté contraindicada una estatina.
Otro de los fármacos aprobados por la CIPM es Nustendi (ácido bempedoico/ezetimiba): está indicado en adultos con hipercolesterolemia primaria (familiar heterocigótica y no familiar) o dislipidemia mixta, como adyuvante a la dieta; o en combinación con una estatina en pacientes que no puedan alcanzar sus objetivos de C -LDL con la dosis máxima tolerada de una estatina más ezetimiba; o en monoterapia en pacientes intolerantes a las estatinas o en los que esté contraindicada una estatina y no puedan lograr los objetivos de C -LDL solo con ezetimiba; o en pacientes ya tratados con la combinación de ácido bempedoico y ezetimiba, en comprimidos independientes con o sin estatina.
Duodopa (foslevodopa/foscarbidopa por vía subcutánea) también ha recibido aprobación para el tratamiento de la enfermedad de Parkinson en estado avanzado, en pacientes que responden a levodopa, con fluctuaciones motoras graves e hipercinesia o discinesia cuando las combinaciones de medicamentos disponibles para el Parkinson no han proporcionado re sultados satisfactorios. Bylvay H (odevixibat), también tendrá financiación pública para el tratamiento de la colestasis intrahepática familiar progresiva (C IFP) en pacientes de 6 meses de edad o mayores.
Vazkepa (icosapento de etilo), es también otra de las formulaciones que ha recibido luz verde para su financiación. Este fármaco está indicado para reducir el riesgo de eventos cardiovasculares en pacientes adultos tratados con estatinas con riesgo cardiovascular alto con triglicéridos altos (≥150 mg/dl [≥ 1,7 mmol/l]) y una enfermedad cardiovascular diagnosticada, o diabetes y, al menos, otro factor de riesgo cardiovascular.
Reblozyl (luspatercept) contará con financiación para el tratamiento de pacientes adultos con anemia dependiente de transfusiones debida a síndromes mielodisplásicos (SMD) de riesgo muy bajo, bajo e intermedio, con sideroblastos en anillo, que obtuvieron una respuesta insatisfactoria o no son candidatos a los tratamientos basados en la eritropoyetina, asi como para el tratamiento de la anemia asociada a betatalasemia (β-talasemia) dependiente de transfusiones y no dependiente de transfusiones.
Cierra la lista de nuevos fármacos aprobados para su financiación, Xevudy (sotrovimab), dirigido al tratamiento de la enfermedad por coronavirus 2019 (covid-19) en adultos y adolescentes (12 años o mayores y que pesen al menos 40 kg) que no requieren oxígeno suplementario y que tienen un mayor riesgo de progresar a covid-19 grave.
En cuantro a las nuevas indicaciones de medicamentos ya financiados en otras indicaciones para los que la CIPM ha propuesto la financiación en esta reunión, se encuentran Libtayo (cemiplimab) indicado, en combinación con quimioterapia basada en platino está indicado para el tratamiento de primera línea de pacientes adultos con C PNM que expresan PD -L1 (en ≥ 1% de las células tumorales) sin aberraciones EGFR, ALK o ROS1, que tienen CPNM localmente avanzado que no son candidatos a recibir quimiorradiación definitiva, o CPNM metastásico. Así como para el tratamiento de pacientes adultas con cáncer de cuello uterino metastásico o recurrente cuya enfermedad ha progresado durante o después de quimioterapia basada en platino.
Lynparza (olaparib), en monoterapia o en combinación con terapia endocrina para el tratamiento adyuvante de pacientes adultos con cáncer de mama temprano HER2 -negativo, de alto riesgo, con mutaciones germinales en BRC A1/2 y que hayan recibido previamente tratamiento con quimioterapia neoadyuvante o adyuvante.
Skyrizi (risankizumab): tratamiento de pacientes adultos con enfermedad de Crohn activa de moderada a grave que han tenido una respuesta inadecuada, han perdido respuesta o han sido intolerantes al tratamiento convencional o a un fármaco biológico. Olumiant (baricitinib): tratamiento de la alopecia areata grave en pacientes adultos.
Adicionalmente, la CIPM ha propuesto la ampliación de la financiación de otros dos medicamentos: Forxiga/Edistride (dapagliflozina), indicado para adultos para el tratamiento de la insuficiencia cardíaca crónica sintomática. Extensión de la indicación previa y Bavencio (avelumab): en monoterapia para el tratamiento de mantenimiento de primera línea de los pacientes adultos con carcinoma urotelial (C U) localmente avanzado o metastásico libres de progresión después de recibir quimioterapia basada en platino. Se elimina la restricción para pacientes adultos con tumores PD-L1 positivos.















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: