Sandoz ha presentado datos de un nuevo estudio fase III doble ciego y aleatorizado con GP2017, biosimilar de Humira (adalimummab), que según la compañía ha confirmado una eficacia equivalente a su comparador original, así como buena seguridad e inmunogenicidad.
Concretamente, entre los resultados presentados durante el Congreso de la American Academy of Dermatology (AAD) en Orlando, Florida, destaca la demostración de una eficacia equivalente, al demostrar tasas de respuesta PASI 75 del 67% para el biosimilar adalimumab propuesto y del 65% para el medicamento de referencia en pacientes con psoriasis en placas crónica de moderada a grave.
Mark Levick, responsable global de Development Biopharmaceuticals en Sandoz, señaló que la importancia de estos datos tiene que ver con que "actualmente se estima que sólo el cinco por ciento de los pacientes con psoriasis aptos obtienen los biológicos que necesitan". "Nos alegra que los datos confirmen la posibilidad de que nuestro biosimilar adalimumab, de aprobarse, se convierta en otra opción de tratamiento para la psoriasis en placas de moderada a grave y otras enfermedades inflamatorias", añadió.
Los resultados en la semana 17 también demostraron una seguridad e inmunogenicidad similar entre el GP2017 y el medicamento de referencia. Los acontecimientos adversos observados y la presencia de anticuerpos anti-fármaco fueron similares en ambos grupos de tratamiento. Los acontecimientos adversos observados coincidieron con el perfil de seguridad conocido del medicamento de referencia.
Además de esta novedad, que permitirá a Sandoz presentar la solicitud de aprobación de su biosimilar adalimumab ante la EMA y la FDA en 2017, la compañía recuerda que también planea lanzar cinco productos biológicos de oncología e inmunológicos para 2020.


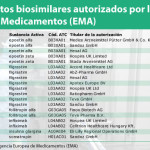














 :
:  Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados:
Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados:  Margarita de la Pisa, eurodiputada de Vox.:
Margarita de la Pisa, eurodiputada de Vox.:  Ion Arocena, director general de la Asociación Española de Bioempresas (Asebio):
Ion Arocena, director general de la Asociación Española de Bioempresas (Asebio):  Javier Padilla, secretario de Estado de Sanidad:
Javier Padilla, secretario de Estado de Sanidad: