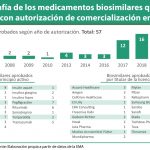
La Agencia Europea de Medicamentos (EMA) ha recomendado la autorización de tres biosimilares de pegfilgrastim, cuyo medicamento de referencia es Neulasta de Amgen.
Esta opinión positiva, que se espera que en las próximas semanas se continúe con la concesión de la licencia de comercialización por parte de la Comisión Europea, se ha otorgado a Pelmeg, de Cinfa Biotech, Fulphila, de Mylan y Ziextenzo de Sandoz.
Primero de Cinfa Biotech
Pelmeg es el primer biosimilar que alcanza la autorización desarrollado por Cinfa Biotech, la filial de Cinfa ha supuesto para el director general de Cinfa Biotech, Ruediger Jankowsky, “un hito importante en nuestro esfuerzo por ofrecer a los pacientes opciones de tratamiento de alta calidad y asequibles”. Además, desde esta firma lo ven como una validación de su enfoque para el desarrollo de su cartera de productos.
Por su parte, el director Global de Desarrollo de Biofarmacéuticos de Sandoz, Mark Levick, señaló que harán “todo lo posible” para ofrecer a los pacientes una alternativa que pueda beneficiar a los pacientes que hasta el momento no se benefician del tratamiento con pegfilgrastim, un tratamiento “de eficacia y seguridad demostradas para las infecciones asociadas a la neutropenia febril”.
Pegfilgrastim es una forma de acción prolongada de filgrastim, un medicamento biosimilar que estimula la producción de glóbulos blancos y células madre. Las indicaciones autorizadas son las mismas que las del medicamento de referencia. En concreto se utiliza para prevenir la neutropenia febril inducida por quimioterapia.
















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: