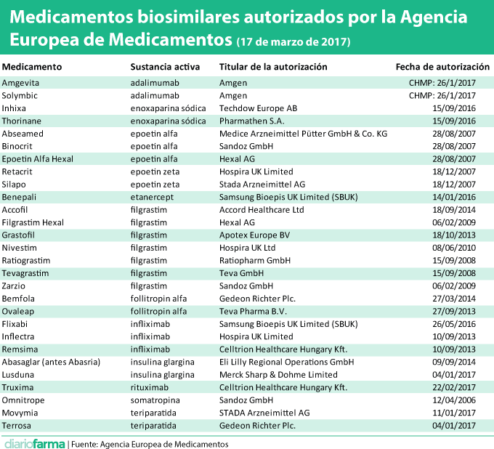
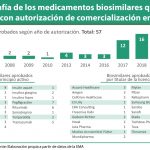
La Agencia Europea del Medicamento (EMA) aprobado hasta el día de hoy un total de 28 medicamentos biosimilares de doce sustancias activas diferentes. En los últimos meses ha aprobado diez nuevos de siete sustancias distintas, lo que da idea del impulso a estos medicamentos.
Las últimas autorizaciones emitidas por la Comisión Europea se corresponden con el rituximab de Celltrion, comercializado como Truxsima, que en España comercializará Kern Pharma y que supone el primer biosimilar con indicación en oncología; dos Teriparatidas comercializadas por Stada y Gedeon Richter, así como una insulina glargina de MSD, comercializada como Lusduma.
Además, en los próximos meses irán sucediéndose nuevas aprobaciones de estos productos ya que actualmente la EMA registradas solicitudes de múltiples medicamentos biosimilares, entre las que destacan los de adalimumab, bevacizumab o trastuzumab, entre otros, como pegfilgrastim.
Distintos biosimilares de estos tres tienen anticuerpos monoclonales han presentado a lo largo de 2016 sus solicitudes de autorización. En el caso del rituximab de Celltrion pasaron 14 meses desde la solicitud a la opinión positiva, por lo que es de esperar que a lo largo del presente año vayan sucediéndose las autorizaciones de estos nuevos medicamentos. Se trata de productos de un importante valor terapéutico y con grandes ventas a lo largo de todo el mundo por lo que también son productos muy interesantes para el desarrollo de biosimilares.
Próximas autorizaciones
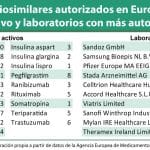
El de adalimumab (Humira de Abbvie) será probablemente uno de los primeros en llegar ya que la EMA ha emitido ya opinión positiva dos biosimilares de Amgen de este producto (Amgevita y Solymbic) con lo que se espera para los próximos días la autorización de comercialización por parte de la Comisión Europea. Posteriormente llegará también un biosimilar de adalimumab de Sandoz.
Respecto a bevacizumab, son también varios los laboratorios que están detrás de ser el primero. Amgen-Allergan, Pfizer, Boehringer o Mylan son algunos de los laboratorios que tienen en desarrollo un biosimilar del Avastin de Roche. Amgen-Allergan presentaron su solicitud de autorización el pasado 2 de diciembre.
Trastuzumab (Herceptin de Roche) también tiene diferentes biosimilares en desarrollo. Amgen, Pfizer, Stada, Mylan, Celltrion son algunos de los laboratorios que están detrás del lanzamiento de un biosimilar. A finales del pasado mes de agosto Mylan presentó el primer registro de este biosimilar en la EMA.















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia:
Un comentario
¿NO ESTÁ REMICADE??