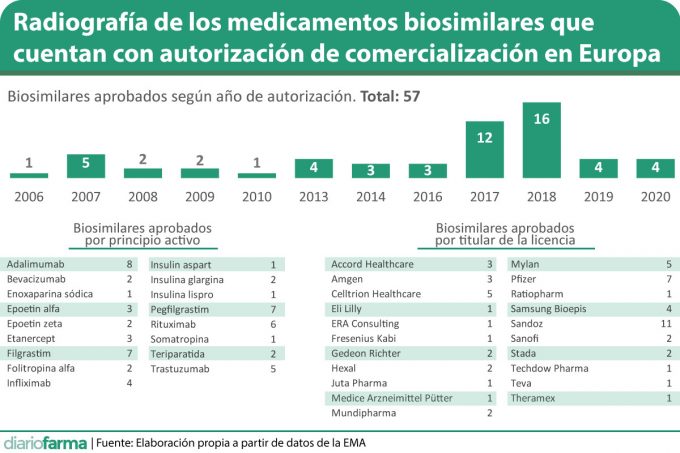
La Unión Europea dispone para su utilización hasta 57 medicamentos biosimilares con licencia de comercialización en vigor. Un total de 57 medicamentos que se distribuyen en 17 principios activos de 21 titulares de la licencia de comercialización diferentes.
El último de los biosimilares disponibles, con autorización por parte de la Comisión Europea, la insulina aspart de Sanofi, aunque para los próximos meses se espera la decisión para Aybintio, un biosimilar de bevacizumab desarrollado por Samsung Bioepis, que recibió hace unos días la opinión positiva del Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea de Medicamentos (EMA).
La insulina aspart es el último principio activo en contar con un biosimilar, con lo que ya son 17 los fármacos que disponen de uno de ellos. Los que más medicamentos autorizados presentan son adalimumab (ocho biosimilares); filgrastim (siete); pegfilgrastim (siete); rituximab (seis) y trastuzumab (cuatro).
Por su parte, la compañía con más biosimilares es Sandoz, que tiene comercializados hasta el momento 11. Le sigue Pfizer con siete; Mylan y Celltrion Healthcare cojn cinco.
Además, cabe señalar que en lo que llevamos de 2020 se han autorizados cuatro biosimilares, los mismos que en todo 2019. No obstante, las cifras de estos dos años se encuentran lejos de las que se registraron en 2017 y 2018, cuando con 12 y 16 biosimilares aprobados se vivió una auténtica explosión de estos productos tanto en términos cuantitativos como en términos cualitativos ya que es cuando se autorizaron un gran número de anticuerpos monoclonales biosimilares y otros medicamentos de relevancia.

Además cabe señalar que otros once medicamentos biosimilares iniciaron la tramitación de su autorización de comercialización pero abandonaron el procedimiento o fueron rechazados.














 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: 