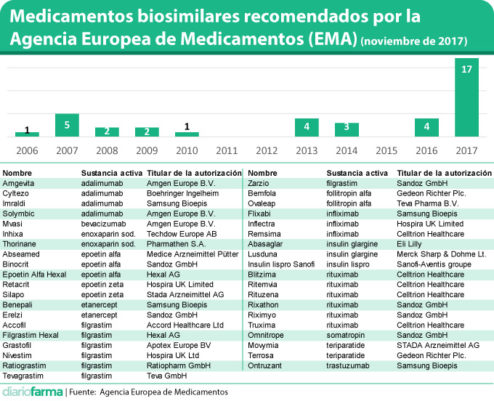
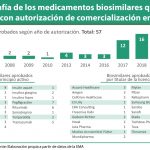
Un total de 39 biosimilares han contado con el aval de la Agencia Europea de Medicamentos (EMA) en los últimos 11 años. De ellos, 17, el 44%, han obtenido su licencia de comercialización durante 2017, lo que muestra claramente el momento tan importante en el desarrollo de estos productos en el que nos encontramos (ver tabla en pdf).
El último en recibir el beneplácito de la EMA ha sido Mvasi, el biosimilar de bevacizumab de Amgen, biosimilar de Avastin, que obtuvo la recomendación positiva de la EMA en la última reunión del Comité de Medicamentos de Uso Humano (CHMP), por lo que podría obtener su licencia de comercialización en los primeros días de enero de 2018.
Con este nuevo producto, a lo largo de 2017 se habrían aprobado biosimilares de importantes medicamentos como adalimumab, rituximab, trastuzumab o teriparatida, que se suman a las recientes autorizaciones de diversos infliximab o etanercept. En el caso de trastuzumab, cabe señalar que Ontruzant, de Samsung Bioepis, ha sido autorizado por la Comisión Europea este lunes.
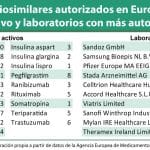
Entre los laboratorios que cuentan con más medicamentos biosimilares de sustancias activas distintas, cabe destacar a Sandoz (5 biosimilares); Samsung Bioepis (4); Hospira (3); Amgen (2) o Celltrion (2). En total, 19 laboratorios diferentes cuentan, como mínimo, con un medicamento biosimilar aprobado, de alguna de las 15 sustancias activas que cuentan con un producto de estas características.
En España hay, hasta el momento, comercializados biosimilares correspondientes a nueve sustancias activas, además de condroitin sulfato, que no está contemplado por la EMA. Estas nueve sustancias tienen un total de 70 presentaciones, tal y como se recoge en la base de datos CIMA de la Agencia Española de Medicamentos (Aemps).















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: 