La Agencia Europea de Medicamentos (EMA) recomendó hace unos meses la autorización de dos biosimilares de trastuzumab y la Comisión Europea sus licencias de comercialización. Estos medicamentos, desarrollados por Celltrion y por Samsumg Bioepis serán comercializados respectivamente en España por Kern Pharma, bajo la denominación de Herzuma y por MSD, bajo la marca de Ontruzant.
Tanto Herzuma como Ontruzant, que tienen como medicamento de referencia a Herceptin de Roche, ya han sido comercializados en algunos países en Europa como Reino Unido o Alemania y se espera que suceda lo mismo en nuestro país en las próximas semanas.
Con este lanzamiento Kern comercializará en nuestro país y Portugal tres biosimilares desarrollados por Celltrion Healthcare: Remsima (infliximab), Truxima (rituximab), además del mencionado Herzuma.
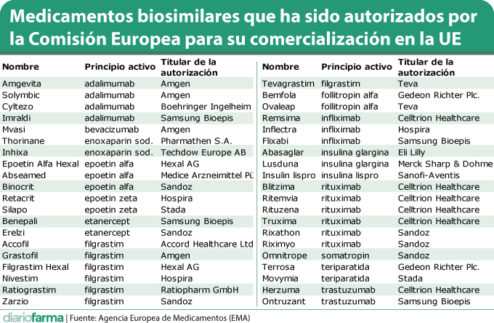
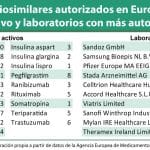
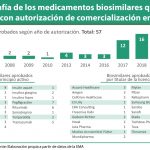
Con estas nuevas autorizaciones, la Unión Europea cuenta con un total de 40 medicamentos biosimilares de 14 principios activos, pertenecientes a 20 laboratorios diferentes a disposición de los pacientes.
En la actualidad en nuestro país, según la base de datos CIMA de la Agencia Española de Medicamentos (Aemps) se encuentran autorizados un total de 137 presentaciones de medicamentos biosimilares. Los últimos autorizados por la Aemps, los biosimilares mencionados de trastuzumab y Amgevita, el biosimilar de adalimumab desarrollado por Amgen, además de varias enoxaparinas, entre ellas, las desarrolladas por Rovi.













 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: