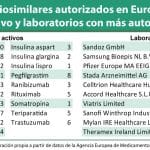
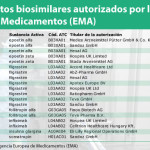
Sandoz ha anunciado que la Agencia Europea de Medicamentos (EMA) ha aceptado la solicitud para presentar el registro del biosimilar de Neulasta (pegfilgrastim), registrado en Europa por Amgen, un factor recombinante humano estimulante de colonias de granulocitos (G-CSF). Sandoz ha solicitado la aprobación para la misma indicación que el producto de referencia.
Se trata, según la propia compañía de una decisión que “refuerza” el programa de biosimilares de la compañía, que se consolida como líder en este ámbito. “En solo cinco meses, hemos conseguido realizar cinco solicitudes de registro, lo que demuestra un gran progreso en nuestra inversión estratégica a largo plazo en biosimilares” aseguró Richard Francis, CEO Mundial de Sandoz.
La estrategia de la compañía prevé seguir avanzando en la cartera de biosimilares, “una de las prioridades del año”, explica Francis, por lo que seguirán invirtiendo “sustancialmente” para llevar su cartera de productos a los pacientes.
Pegfilgrastim es un medicamento de prescripción médica indicado en el tratamiento de pacientes diagnosticados de cáncer tratados con quimioterapia (excepto aquellos con leucemia mieloide crónica y síndrome meloideoplásico) para contribuir a paliar algunos de los efectos secundarios del tratamiento. Este fármaco reduce la duración de la neutropenia (recuento bajo de neutrófilos, un tipo de glóbulo blanco que combate las infecciones) y la incidencia de neutropenia febril (neutropenia con fiebre) como consecuencia de los tratamientos con quimioterapia. La incidencia de neutropenia febril (NF) se produce en tratamientos con quimioterapia en un 25 al 40% de tratamientos en pacientes nuevos.


















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: