La división de genéricos de Novartis tiene previsto lanzar cinco medicamentos biosimilares en oncología e inmunología antes de 2020, “con el ánimo de facilitar el acceso a las terapias biológicas”, han informado responsables de la compañía en un encuentro con medios en su recién inaugurada planta de Schaftenau (Austria).
Richard Francis, máximo responsable de Sandoz, declaró en el encuentro: “A pesar de los impresionantes avances de la Medicina en los últimos años, sigue habiendo un considerable número de necesidades terapéuticas por atender, tanto en los países con menos recursos como en los desarrollados. Los medicamentos biológicos han supuesto una revolución en el tratamiento de muchas enfermedades graves y discapacitantes, pero hay muchos pacientes que no tienen acceso a ellos. Nos hemos propuesto mejorar el acceso a estas terapias con el lanzamiento de medicamentos biosimilares en los próximos años”.
Dependiendo de los trámites de aprobación, los próximos lanzamientos previstos son biosimilares de productos cuyo uso está enormemente extendido: Humira (adalimumab, de AbbVie), Enbrel (etanercept, de Amgen), Neulasta (pegfilgrastim, también de Amgen), Remicade (infliximab, de Johnson & Johnson) y Rituxan (rituximab, de Roche). En 2015, estos medicamentos generaron ventas por valor de 43.600 millones de dólares.
El último biosimilar de Sandoz aprobado en Europa fue rituximab, el pasado mes de mayo. En la cartera de la compañía hay biosimilares del área de oncología, entre otras, y cada año se están poniendo en marcha nuevos programas.
Ahorro de 49.000 a 98.000 millones de euros
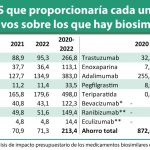
Según Francis, los biosimilares pueden desempeñar un papel determinante en la transformación de la atención sanitaria generando ahorros acumulados dentro del rango de los 49.000-98.000 millones de euros en los próximos cuatro años considerando los mercados estadounidense y europeo.
En el encuentro de Schaftenau, Carol Lynch, responsable de terapias biológicas de Sandoz, recordó que el 5% de todos los pacientes con psoriasis reciben en la actualidad este tipo de tratamiento, y se refirió a datos presentados en el último encuentro de la Sociedad Americana de Oncología Clínica (ASCO) para recordar que el 25% de las personas con cáncer en Estados Unidos no pueden permitirse los medicamentos que necesitan.
“Con la factura de medicamentos especializados constantemente al alza, el precio es una barrera importante en el acceso a la atención médica. Los biosimilares tienen una función crucial en aliviar esa carga para los pacientes y los sistemas sanitarios”, añadía.
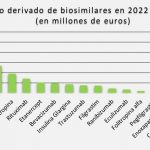
A partir de datos de la consultora IMS, Lynch puso de relieve que siete de los diez fármacos más vendidos en todo el mundo van a perder sus patentes entre 2016 y 2020 (adalimumab, etanercept, infliximab, rituximab, insulina glargina, bevacizumab y trastuzumab).
Según sus cálculos, el mercado de biogenéricos crecerá a un ritmo promedio del 62% en este periodo, tanto en Estados Unidos como en Europa y el resto del mundo. Por áreas terapéuticas estiman que los biosimilares de insulinas crecerán un 142%; los biosimilares de eritropoyetina, factor de estimulación de colonias de granulocitos y hormona del crecimiento lo harán en un 35%, y los del área de inmunología, un 92%. Según aclaró, no se disponía de estimaciones actualizadas para el área de oncología en el momento del encuentro.
Lo que el mercado de biosimilares necesita, a su entender, es el establecimiento de políticas de sostenibilidad, como incentivos a la prescripción; educación orientada a los pacientes y a los profesionales sanitarios y la reducción de incertidumbres legales y regulatorias.
Cuestión de transparencia
Mark McCamish, responsable de desarrollo de medicamentos biológicos de Sandoz, hizo hincapié en la idea de que la transparencia es crucial para que los médicos puedan adoptar decisiones informadas en cuanto a qué producto es mejor para cada paciente. “Sin embargo –indicaba-, los productos han experimentado cambios sin cumplir ese criterio de transparencia en la década pasada, y con frecuencia se han incorporado cambios en los procesos de fabricación”.
Recordaba que los medicamentos biológicos tienen “una variabilidad inherente” al margen de los cambios en la fabricación, pero la idea clave es que un nuevo biosimilar únicamente recibe la aprobación cuando no se observan diferencias clínicas significativas entre éste y el original.













 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: