El nuevo Acuerdo Marco de Vacunas de Gripe 2025, convocado por la Secretaría de Estado de Sanidad, introduce diversos cambios que conducen a mejoras en flexibilidad y optimización de compras respecto al de 2021. Con cambios en la duración, adhesión de entidades y estructura de lotes, el acuerdo busca una gestión más eficiente y adaptable a las necesidades sanitarias.
El Acuerdo Marco de 2025, autorizado por el Consejo de Ministros el pasado 28 de enero, mantiene una duración inicial de 2 años, pero introduce prórrogas flexibles que pueden ampliarse hasta un total de 4 años sin una estructura fija de renovaciones anuales. Este cambio contrasta con el modelo de 2021, que contemplaba prórrogas de 1 año cada una y requería una planificación previa para su extensión.
Al tratarse de una duración tan larga, el incorpora mecanismos para poder incorporar las innovaciones que se puedan introducir en el mercado. Dado el desarrollo de nuevas tecnologías en inmunización, esta medida otorga margen para el uso de opciones más efectivas sin esperar al vencimiento del acuerdo.
Además, el mecanismo de adhesión también se ha flexibilizado. Mientras que en 2021 el acuerdo estaba restringido a entidades predefinidas (Administración General del Estado, Ceuta, Melilla y doce comunidades autónomas, todas menos Andalucía, Cataluña, Galicia y País Vasco, y el Instituto Nacional de Gestión Sanitaria, Ingesa), en 2025 repiten todas las entidades, excepto el Ingesa, pero se abre la posibilidad de que otras entidades públicas se adhieran a través de un acuerdo con la Secretaría de Estado de Sanidad. Esto amplía la capacidad de compra centralizada, beneficiando a aquellas instituciones que, por su volumen o estructura, no participaron en acuerdos anteriores.
Menos lotes y redistribución de dosis
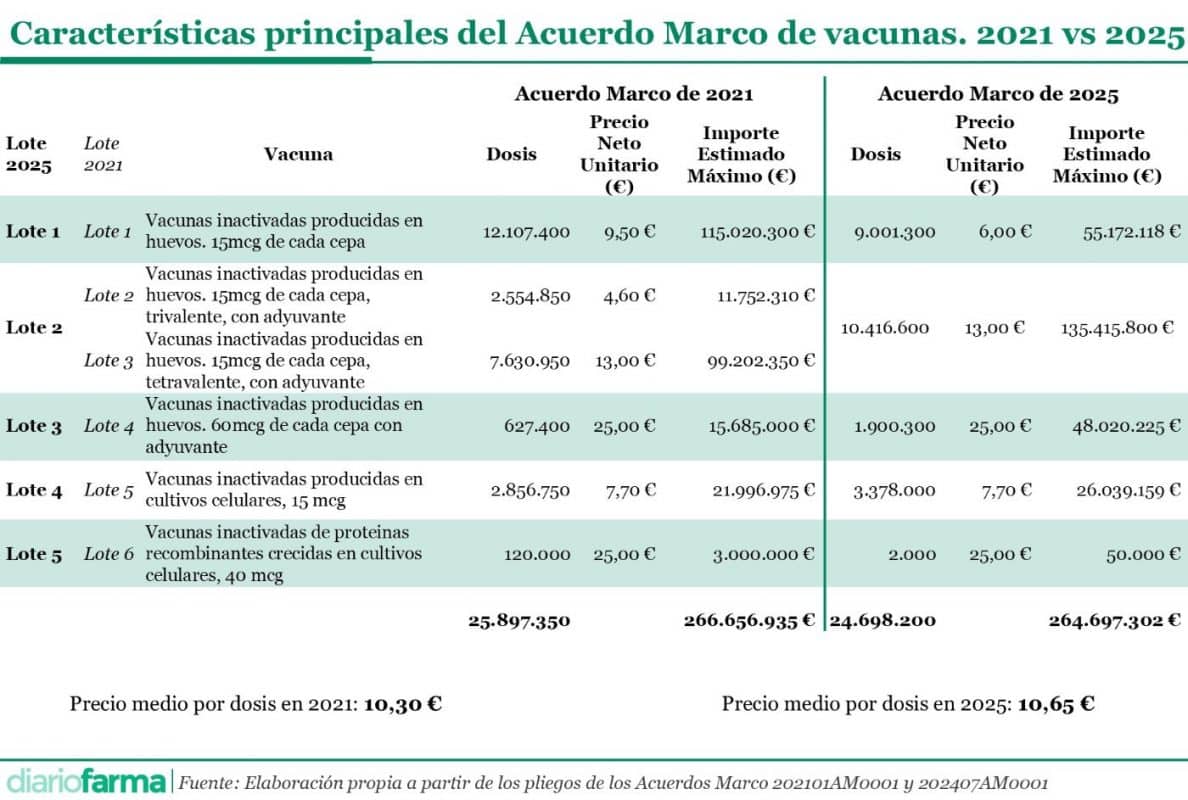
Otro aspecto que destaca en el nuevo acuerdo marco es la reformulación de los lotes. En 2021, el acuerdo contaba con seis lotes diferenciados. Sin embargo, el Acuerdo Marco de 2025 reduce la estructura a cinco lotes, eliminando la diferenciación entre vacunas tri y tetravalentes con adyuvante. Asimismo, se mantiene la separación entre vacunas producidas en huevos embrionados y en cultivos celulares, asegurando que las opciones disponibles se adapten a diferentes necesidades clínicas y restricciones, como las alergias a las proteínas del huevo.
Además, se ha estimado un mayor uso de vacunas del lote 4, vacunas de alta carga, y lote 5, de cultivo celular, en detrimento de las vacunas del lote 1, carga típica sin adyuvante.
Cabe resaltar también la modificación de los precios de los lotes. Las vacunas del lote 1 se comprarán a un precio máximo de 6 euros, significativamente inferior a los 9,50 euros del concurso previo. Por el contrario, al unir los lotes 2 y 3 del concurso de 2021, con precios de 4,6 para las vacunas trivalentes y 13 para las tetravalente, se ha planteado un precio único de 13 euros por dosis en esta ocasión, lo que genera un incremento de la inversión.
En promedio, cada dosis incluida en el acuerdo marco de 2021 supuso un coste de 10,30 euros, frente a los 10,65 euros del concurso actual, lo que supone un incremento del 3,4%, aunque haya vacunas, como las del lote 1 a las que se ha aplicado una rebaja de casi un 37%.
En términos generales también llama la atención la ligera, pero significativa, reducción del número total de dosis a adquirir que se recoge en los pliegos. En concreto, para los dos primeros años se ha estimado un número de dosis de 24.698.200 dosis, cuando en 2021 ascendió a 25.897.350 dosis, una reducción del 4,63%. Esta reducción podría suponer que se renuncia a incrementar los colectivos a los que recomendar la vacunación o, incluso, a incrementar las tasas entre profesionales o mujeres embarazadas o menores de 5 años.
Cambios en la logística y seguridad del suministro
Uno de los cambios más significativos en 2025 afecta a los requisitos de almacenamiento y validez de las vacunas. Mientras que en 2021 se exigía una validez mínima de 8 meses desde la entrega, en 2025 este plazo se reduce a 6 meses, cubriendo siempre la temporada de gripe. Esta modificación permite una mayor rotación de stock y posibilita ajustar los pedidos a la demanda real, y facilita la gestión a las compañías farmacéuticas. Eso sí, también obligará a una mejor gestión de los entes públicos para evitar alcanzar las fechas de caducidad, lo que supondría un desperdicio de las mismas.
Para mitigar esta situación, el acuerdo de 2025 incluye una cláusula que permite a la administración exigir la reposición de dosis no utilizadas si su caducidad impide su uso efectivo. Además, se especifica que, en caso de problemas con la cadena de frío antes de la recepción de las dosis, el proveedor está obligado a reponer las vacunas afectadas. En el anterior acuerdo marco no se especificaba que la responsabilidad del proveedor terminaban con la entrega, hasta la recepción por el órgano de contratación, lo que resulta un cambio relevante.
En cuanto a la presentación de las vacunas, el nuevo acuerdo mantiene la preferencia por jeringas precargadas, aunque se han flexibilizado algunos requisitos de envasado en multidosis. En 2021 se exigía que cada dosis en presentación multidosis estuviera en un blíster individual, una medida que garantizaba la protección de las dosis pero que también incrementaba los costes logísticos. En 2025, se elimina este requisito, permitiendo una presentación diferenciada pero sin envoltorio individual, lo que podría reducir costos sin comprometer la seguridad.
Otros aspectos clave del Acuerdo Marco de 2025
El nuevo acuerdo también introduce ajustes en los criterios de adjudicación, aunque mantiene el precio como factor determinante. Como en 2021, el criterio de selección seguirá siendo la oferta económicamente más ventajosa, sin otros factores cualitativos en la ponderación. Esta continuidad puede interpretarse como una apuesta por la estabilidad en la contratación, asegurando que los precios ofertados sean competitivos.
No obstante, donde sí hay algunos cambios es en los criterios de adjudicación en los contratos basados en el acuerdo marco. En este sentido, se ha eliminado la valoración de la presencia de etiquetas autoadhesivas que identifiquen el laboratorio, producto y lote. Por el contrario se ha añadido un apartado de termoestabilidad a temperatura ambiente y se valora la posibilidad de coadministración.
Los laboratorios interesados en presentar ofertas al acuerdo marco deberán hacerlo antes del próximo 25 de marzo.













 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: