La última reunión de la Comisión Interministerial de Precios de los Medicamentos (CIPM) de 16 de julio se ha caracterizado por sus decisiones en relación a los medicamentos genéricos. En concreto, las referidas a genéricos hospitalarios aunque no se sabe si se debe a decisiones puntuales o si marca un antes y un después.
La CIPM aprobó tres genéricos de idarubicina, un citotóxico que hasta ahora solo contaba con el fármaco original, Zavedos de Pfizer y un genérico de Sandoz. El precio aprobado para el nuevo medicamento genérico contiene una rebaja del 33% con respecto a las presentaciones existentes en la actualidad. Así, mientras que las presentaciones de 10 mg 1 vial de los medicamentos comercializados hasta el momento tenían un PVL de 81,8 euros. La nueva presentación autorizada de Accord se lanzará con un PVL de 61,35 euros, precio al que se tendrán que adaptar el resto para no quedar desfinanciados.
La Comisión de Precios ha aprobado rebajas de precio superiores al 40% para varios nuevos genéricos hospitalarios
De este modo, dado que con el lanzamiento del genérico de Sandoz se habría aplicado una reducción del 40%, el nuevo precio supondrá una reducción del 55% con respecto al precio original.
Además, cuando este conjunto se revise con los precios de referencia, sufrirá una importante reducción de precio en las presentaciones de menor dosificación debido al registro de una presentación de 20mg y 20ml con un precio no proporcional al resto. En concreto, la presentación de 10 mg 1 vial de 10 ml pasará de un PVL de 81,8 euros actuales a 23,01 euros cuando se revisen los precios de referencia, bajando un 71,8%. La presentación de 5 mg 1 vial de 5 ml bajará aún más: de 40,9 euros pasará a 5,75, un 86% de reducción sobre el precio actual y un 91,5% de reducción respecto al precio original.
Otro ejemplo de esta posible nueva política de la CIPM se refiere al nuevo genérico de bortezomib. Velcade de Janssen posee en la actualidad un PVL de 1.120,14 euros, mientras que, al nuevo genérico aprobado, de Stada, se le ha aprobado un precio de 545,71 euros. Esto supone una reducción del precio de un 51,3%. Se podría pensar que el cálculo de la reducción del precio se realiza con respecto al PVP real de adquisición del SNS y no sobre el precio notificado, pero aún así, la reducción es superior al 40% establecido de forma ordinaria.
Un tercer caso, es el nuevo genérico de lopinavir/ritonavir de Accord, que es equivalente con Kaletra de Abbvie y que se le ha asignado un precio que supone una reducción del 50,5% con respecto al PVL autorizado. Haciendo la comparación con el precio real de adquisición por el SNS, la reducción también resulta ser superior al 45%.
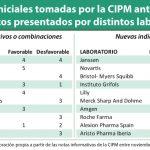
La CIPM del 16 de julio aprobó dos biosimilares de adalimumab y uno de trastuzumab y ha dejado sin aprobar varias presentaciones de biosimilares de adalimumab
Por tanto, una vez que se comercialicen los medicamentos autorizados por la CIPM, los originales y otros genéricos implicados tendrán que asumir una reducción de precio que no entraba en sus cálculos al ser superior al 40% que hasta ahora se había considerado como fijo y oficial.
Estos tres casos, no obstante, no suponen una generalización de esta práctica para todos los medicamentos hospitalarios. La misma CIPM aprobó el primer genérico de anidulafungina, que mantiene una reducción del 40% con respecto al original. Otros genéricos de interés aprobados por la misma comisión son los de paliperidona (Invega de Janssen) o prasugrel (Effient de Lilly).
Otras aprobaciones
En total, la CIPM del pasado julio aprobó un total de 19 nuevos medicamentos de nueve principios activos diferentes. Según la información incluida en la nota informativa de dicha reunión, se aprobaron, en concreto, dos presentaciones de Tovedeso (desfesoterodina) de Teva; tres de Skilarence (fumarato dimetilo) de Almirall) y una de Varuby (rolapitant) de Tesaro Bio Spain; además de una nueva presentación de Benlysta (belimumab), de GSK y otra de Vesicare de Astellas.
Además, se han aprobado tres nuevos biosimilares. En concreto, dos de adalimumab (Amgevita de Amgen e Imraldi de Biogem) y uno de trastuzumab (Kanjinti de Amgen). Cabe señalar que la propia acta de la CIPM recoge como medicamentos con propuesta desfavorable de precio varias presentaciones de los biosimilares de adalimumab que, de este modo, no estarán disponibles en España. Se trata, principalmente, de presentaciones con 4 o 6 jeringas o plumas precargadas para las que no se ha otorgado precio.
En trámite de alegaciones se encuentran cuatro fármacos: dos de Glyxambi, de Boehringer Ingelheim; Kyntheum de Leo y Bavencio de Merck.
Por otro lado, cinco nuevos medicamentos han tenido una propuesta desfavorable de financiación. Tres presentaciones de Latura de Angelini, una de Lutathera de Advanced Accelerator Applications Iberica y una de Tremfya de Janssen. En el epígrafe de otros medicamentos también han obtenido propuesta desfavorable un fármaco de Tedec Meiji (Dovida, sulodexida DCI), uno de Alfasigma (Aterina, sulodexida DCI) y uno de Aristo (Xamban, hidroxicloroquina DCI).

















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: