Hasta 78 laboratorios han visto pasar las decisiones de aprobación de sus medicamentos por la Comisión Interministerial de Precios de los Medicamentos (CIPM) desde noviembre de 2017. De ellos, 43 han presentado nuevos medicamentos o combinaciones, de los que en una primera reunión han sido aprobados 46 (54,8%) y rechazados 38 (45,2).
Así se desprende del análisis realizado por Diariofarma en base a los datos contenidos en las notas informativas de la CIPM que publica el Ministerio de Sanidad desde noviembre de 2017 y que, por el momento, ha hecho accesible la información a nueve reuniones.
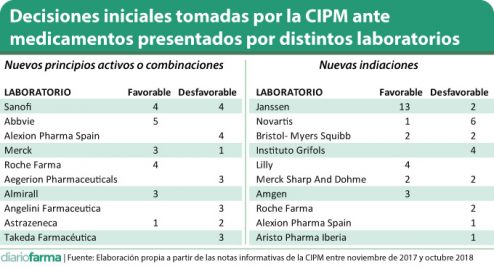
Los laboratorios con mayor número de medicamentos con nuevos principios activos o combinaciones presentados a la CIPM son Sanofi (ocho); AbbVie (cinco) y con cuatro Merck, Roche y Alexion.
La suerte corrida por cada uno de ellos ha sido muy dispar en esa primera ocasión de revisión del medicamento por la CIPM. Sanofi obtuvo cuatro acuerdos favorables y otros cuatro desfavorables; AbbVie pleno de vistos bueno; Alexión, por el contrario, cuatro negativas; Merck tres favorables y una desfavorable y Roche cuatro favorables.
Nuevas indicaciones
En cuanto a la solicitud de nuevas indicaciones, del total de 50 presentaciones, de 15 laboratorios diferentes, que han pasado por ese trámite, se han aprobado 28 (56%). Por compañías, Jannsen ha solicitado la aprobación para 15 presentaciones, eso sí, 13 para distintos formatos de Eprex; Novartis para siete presentaciones de cinco principios activos diferentes; BMS cuatro, al igual que Grifols, Lilly o MSD.
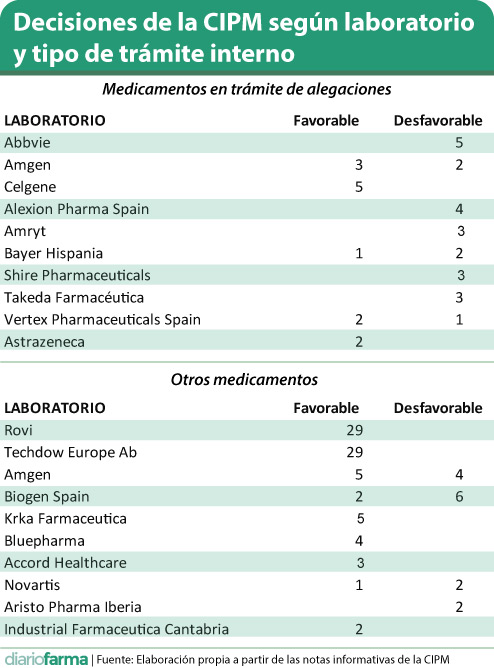
En lo que se refiere a medicamentos en trámite de alegaciones, por el que han pasado 67 presentaciones de 32 laboratorios y se han aprobado 33 (49,3%), cabe destacar AbbVie con cinco, todas negativas; Amgen con tres decisiones favorables y dos contrarias; Celgene con cinco favorables y Alexion con cuatro, las cuatro desfavorables.
Por su parte, el procedimiento englobado en el epígrafe ‘otros medicamentos’ ha dado trámite a un total de 119 medicamentos de 29 laboratorios. Entre ellos destacan Rovi y Techdow, con 29 presentaciones cada uno de sus heparinas de bajo peso molecular; seguidos por Amgel, con nueve solicitudes (cinco favorables y cuatro negativas); Biogen con ocho (dos aprobadas y seis no) y KRKA Farmacéutica con cinco aprobadas.
Es necesario dejar claro que los casos de Amgen y Biogen se debe a la no financiación de algunas presentaciones de sus biosimilares de adalimumab en una decisión tomada al tiempo que se aprobaban otras.
Pfizer y GSK, casi ausentes
Por último, es interesante resaltar que dos laboratorios que se encuentran en el top-ten mundial de ventas han estado casi ausentes en las nueve reuniones de la CIPM analizadas. Se trata de Pfizer y GSK. La multinacional americana solo ha obtenido precio para un nuevo medicamento a lo largo de todo un año. En concreto, se trata de su vacuna frente al meningococo B Trumenba. Además, ha obtenido una nueva indicación para Tygacil. Por su parte, GKS solo ha obtenido autorización para su tratamiento del lupus Benlysta.
En relación con las decisiones contabilizadas, es necesario dejar claro que se trata de las veces que una determinada presentación ha pasado por la CIPM, no de medicamentos que han sido aprobados o rechazados puesto que hay muchos medicamentos que en un principio recibieron una decisión negativa y tras pasar por el trámite de alegaciones fueron finalmente aprobados.















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: