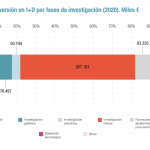
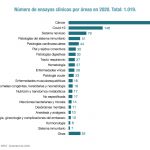
Es muy pronto para valorar el impacto que pueda tener la nueva exigencia de las agencias regulatorias en relación con la presencia de nitrosaminas en los medicamentos de síntesis química, sean éstos genéricos, de marca, con receta o sin ella. La incertidumbre es el sentimiento que reina actualmente en el seno del sector, ya que de los resultados de los análisis de riesgos que se hagan va a depender el alcance de las medidas que se tengan que aplicar luego.
Farmaindustria explica, en relación con esto, que "todos los medicamentos están permanentemente monitorizados, tanto por las autoridades sanitarias, como por las compañías farmacéuticas, para garantizar los máximos estándares de seguridad, calidad y eficacia". No obstante, la reciente aparición de una nitrosamina en la ranitidina, sumada a la detección previa en los conocidos como sartanes, ha hecho que las agencias planteen la necesidad de una exhaustiva investigación en el resto de medicamentos de síntesis química que permita descartar niveles significativos de estas impurezas en otros fármacos comercializados.
Desde un laboratorio nacional aclaran que esta situación nada tiene que ver con otras crisis anteriores, en las que algunas compañías habrían actuado de forma negligente para maximizar sus beneficios. La nueva exigencia tiene que ver, indican, "con que las técnicas de diagnóstico y análisis han avanzado y son capaces de detectar impurezas que antes no se veían".
La patronal de los laboratorios de medicamentos originales no espera "que se formen este tipo de impurezas durante la síntesis de la gran mayoría de las sustancias activas", y tiene la impresión de que solo afectará a "algunos específicos grupos químicos". No obstante, no descartan que "que en determinadas rutas de síntesis, o durante la producción bajo ciertas condiciones, y cuando se emplean ciertos solventes, reactivos y otras materias primas, estas impurezas aparezcan", casos en los que, recuerdan, "deberán controlarse y eliminarse durante el proceso de fabricación".
Desde un laboratorio multinacional indican que "el proceso de revisión puede resultar más o menos complejo, en función de las características de la planta y del proceso de producción que se siga para cada medicamento". También va a ser determinante el catálogo de productos de cada compañía. En una de capital nacional que ha sido consultada por este periódico respiran tranquilos, ya que "buena parte" de los que componen su facturación son biológicos, "que quedan exentos". No obstante, producen también producto sólido y fabrican a terceros, por lo que no podrán eludir del todo los nuevos requerimientos.
Diferentes escenarios y acciones a llevar a cabo
Tomando como referencia este caso concreto, cabe aclarar que los laboratorios titulares de comercialización de productos de síntesis química pueden ser fabricantes de la API y el producto terminado, o solo de los segundos. El primer caso, tendrá que aplicar el análisis de riesgos sobre sus API y, a partir de ahí, ver si hay que corregir algo. Sin embargo, cuando la API se la fabrican fuera tendrá que cerciorarse de cómo su proveedor la produce para, a partir de ahí, concluir cuáles son los riesgos. También pueden ser simplemente fabricante a terceros, casos en los que su labor será, más bien, la de dar soporte al titular de comercialización, pidiendo información al proveedor de la API.
De las conclusiones sobre los riesgos se pueden derivar varias intervenciones, con distinto nivel de importancia. "Desde la mera acreditación de ausencia de riesgos a tener que modificar todo el proceso de producción, lo que te puede llevar entre 1 y 2 años", indican desde el laboratorio nacional consultado, desde donde imaginan que ante un riesgo mayor podrían tener que llevarse a cabo "los trabajos para modificar reactivos y algunas fases del proceso, que habría que cualificar y validar, para alcanzar niveles pertinentes". "Todo eso, después, habría que incluirlo en el dossier del producto", añaden, situando el mayor nivel de riesgo en los fabricantes de productos cuya estructura orgánica incluye "anillos tetrazoles, que parecen más susceptibles de generar nitrosaminas", los cuales, además, tendrán que revisar todo lo que se produzca en esa línea para comprobar que no se ha dado una contaminación entre lotes.
El sector de genéricos, sensible al aumento de costes
Estas operaciones más complejas que se pueden derivar de los escenarios de riesgo mayor pueden resultar especialmente gravosas, según Aeseg, para los fabricantes de medicamentos genéricos. A este respecto, recuerda que estos laboratorios son titulares "de un número elevado de APIs", lo que hará que el número de procesos de revisión también se eleve.
Recuerdan, a este respecto, que el sector "ha tenido que asumir recientemente otros costes, como los de la serialización, para unos productos que suelen salir ya al mercado con precios muy ajustados". "Los laboratorios de genéricos ya estamos muy sensibilizados ante todo lo que supone un aumento de costes, teniendo en cuenta que contamos además con una regulación que parte de una bajada de precios constante", indican, aunque asumen, de la misma forma, que "garantizar la seguridad de los fármacos" que comercializan es su "obligación".
Bajo esa premisa, tanto Aeseg como Farmaindustria se declaran a la espera de recibir nuevas indicaciones de la Agencia Española de Medicamentos y Productos Sanitarios (Aemps) para poder informar a sus socios de los pasos a seguir y contribuir a que todos cumplan con los requerimientos que se les exijan para garantizar la seguridad de los pacientes.













 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: