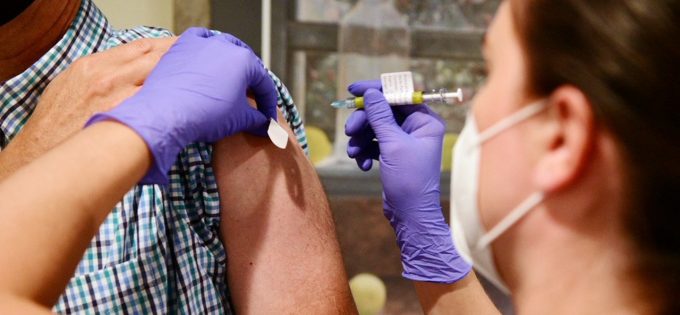
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ha comunicado la autorización del ensayo clínico fase III Ensemble 2 con la vacuna contra la covid-19 de Janssen (compañía de Johnson&Johnson), siendo así el primer ensayo de estas características que se llevará a cabo con una de estas vacunas en nuestro país. Cabe recordar que la compañía ya eligió a España para la realización de la fase II de su ensayo.
La Agencia confirma que se trata de un ensayo pivotal, multinacional, con diseño doble-ciego, que servirá para estudiar la seguridad y eficacia de un régimen de dos dosis de esta vacuna, Ad26.COV2.S, que está basada en un tecnología sólidamente documentada con un adenovirus recombinante no replicativo. Para ello, la compañía planea reclutar hasta 30.000 voluntarios de nueve países (Bélgica, Colombia, Francia, Alemania, Filipinas, Sudáfrica, España, Reino Unido y Estados Unidos).
En el caso de España, la Aemps ha confirmado que participarán nueve centros hospitalarios que iniciarán, tan pronto como sea posible, dicho reclutamiento. El protocolo indica que se vacunará inicialmente a participantes sin enfermedades concomitantes que se asocian a un mayor riesgo de progresión a covid-19 grave.
Tras la evaluación por parte de un Comité independiente de vigilancia de los datos de seguridad de estos participantes, se pasaría eventualmente a incluir a participantes con enfermedades concomitantes que sí se asocian a un mayor riesgo de progresión a ese estadio más grave de la enfermedad. Por edades, un 20% de los participantes serán menores de 40 años y un 30% mayores de 60 años.
Durante todo el ensayo se llevará a cabo una monitorización estrecha de todos los voluntarios y una identificación de todos los casos de covid-19 que se vayan produciendo, lo que permitirá realizar un análisis preliminar con datos intermedios, aunque hasta que el ensayo clínico haya finalizado no se podrán "extraer conclusiones finales", indican desde la Agencia, que añade que, "solo tras haber sido evaluados y si cumplen con los estándares regulatorios, será autorizada (la vacuna) para su comercialización".
La Aemps asegura que se mantiene "en contacto con diferentes compañías" que habrían propuesto la inclusión de centros españoles en sus ensayos clínicos con vacunas contra la covid-19.














 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: 