La Comisión Interministerial de Precios de los Medicamentos (CIPM) ha introducido una cláusula en los acuerdos para la financiación de nuevos medicamentos que resulta muy relevante para los nuevos medicamentos. Se trata del compromiso de devolución por parte del laboratorio comercializador de la “diferencia entre el precio actual en el programa de acceso en situaciones especiales y el precio acordado”. Aunque no es una cláusula habitual, expertos en la materia indican a Diariofarma que no es la primera vez en que aparece.
Esto quiere decir que los precios de compra de medicamentos por procedimientos de medicación extranjera, por ejemplo, que de forma habitual son superiores a los que luego se establecen en nuestro país, dejarían de tener relevancia ya que, una vez acordado el precio, el Sistema Nacional de Salud (SNS) recuperaría el exceso de coste en el que hubiera incurrido. La situación previa suponía un incentivo a la CIPM para alcanzar un acuerdo de precio en medicamentos que se estuvieran utilizando por alguna de las vías especiales contempladas en la normativa.
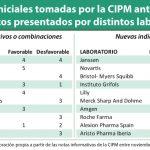
Este acuerdo se refiere a Crysvita (burosumab), de Kyowa Kirin que ha obtenido el visto bueno de la CIPM para su comercialización en España, pero con diversas condiciones. Entre ellas, más allá de esa devolución, destaca el acuerdo de pago por resultados revisable de forma anual; un coste máximo por paciente; seguimiento a través de Seguimed; revisión anual de las ventas y su introducción en Valtermed para recopilar la información necesaria para todo ello. Este medicamento está indicado para el tratamiento de la hipofosfatemia ligada al cromosoma X con signos radiográficos de enfermedad ósea en niños de 1 año y mayores y adolescentes con el esqueleto en crecimiento.
Por otro lado, la CIPM ha aprobado otros medicamentos como Ruconest (conestat alfa), comercializado por Pharming para el tratamiento de las crisis agudas de angioedema en adultos y adolescentes con angioedema hereditario (AEH); Buvidal, jeringa precargada de buprenorfina comercializada por Camurus, para el tratamiento de la dependencia de opioides; y Baqsimi (glucagón), de Lilly, para el tratamiento de la hipoglucemia grave personas con diabetes mellitus mayores de 4 años.
Rechazos de financiación
En lo que se refiere a los rechazos de financiación por parte de la Comisión de Precios, llama la atención la presencia de un biosimilar de infliximab que innova con respecto a las presentaciones existentes en la actualidad. Remsima solución inyectable en jeringa precargada es el primer biosimilar de infliximab para administración subcutánea, según se recoge en la propia nota informativa publicada por la Comisión. La razón esgrimida por la CIPM es la “existencia de medicamentos u otras alternativas terapéuticas para las mismas afecciones a menor precio o inferior coste de tratamiento”.
Otros rechazos de la CIPM se refieren a Lokelma (ciclosilicato de sodio y zirconio), de AstraZeneca, indicado para el tratamiento de la hiperpotasemia en pacientes adultos; Mulpleo (lusutrombopag), de Shionogi, para el tratamiento de la trombocitopenia grave en pacientes adultos con enfermedad hepática crónica que se someten a procedimientos invasivos; Blincyto (blinatumomab), de Amgen, para la leucemia linfobláscita aguda; Mayzent (siponimod), de Novartis, para el tratamiento de pacientes adultos con esclerosis múltiple secundaria progresiva (EMSP); Doptelet (avatrombopag) de Swedish Orphan Biovitrum, para el tratamiento de la trombocitopenia grave en pacientes adultos con enfermedades hepáticas crónicas.
Por otro lado, se ha rechazado la financiación de nuevas indicaciones para Bavencio, de Merk; Perjeta, de Roche; Lonsurf, de Servier.
La CIPM también ha decidido suprimir el visado de inspección al que estaban sometidos las diferentes presentaciones de clozapina. Este medicamento era considerado de ‘especial control médico’, categoría desaparecida hace un año.
También ha aceptado la revisión de precios de Sirdalud, de Bexal y ha rechazado la solicitud para Dolquine, de Laboratorios Rubio. Por otro lado, ha aceptado la desfinanciación de Valcyte de Roche, aunque mantiene la exigencia de receta médica y la calificación de diagnóstico hospitalario.

















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: 