La Federación Española de Empresas de Tecnología Sanitaria (Fenin) ha manifestado su apoyo al sistema de control de calidad y vigilancia que opera en nuestro país y en el ámbito europeo en relación a los productos sanitarios.
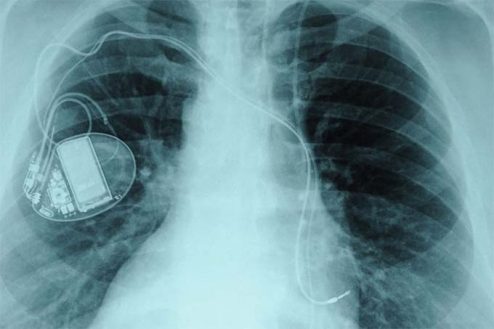
El comunicado de Fenin se produce en respuesta a un investigación realizada por el Consorcio Internacional de Periodistas de Investigación (ICIJ) que han elaborado un reportaje sobre el sistema de evaluación y seguimiento de los productos sanitarios en el que denuncian la existencia de bajas tasas de notificación de problemas relacionados con implantes y otros productos sanitarios.
Fenin explica que, “cada día, millones de personas se benefician de productos sanitarios para la prevención, diagnóstico, tratamiento, seguimiento y curación de enfermedades y mejora de su calidad de vida”.
Además, la federación explica que el sector de Tecnología Sanitaria trabaja con las autoridades y los profesionales sanitarios “para mejorar la salud y la calidad de vida de los pacientes” y que los requisitos para garantizar la seguridad, calidad y funcionamiento de los productos sanitarios “vienen definidos en tres directivas europeas que fueron transpuestas al ordenamiento jurídico español mediante Reales Decretos y que en un corto plazo de tiempo van a ser sustituidos por dos reglamentos europeos: el 2017/745 sobre Productos Sanitarios y el 2017/746 sobre los Productos Sanitarios para el Diagnóstico In Vitro”.
Según Fenin, esta nueva legislación revisa las directivas para adecuarlas al avance tecnológico, garantizar un elevado nivel de seguridad y de protección de la salud, apoyando al mismo tiempo la innovación. Los Reglamentos refuerzan, entre otros aspectos, la supervisión de los Organismos Notificados, los procedimientos de evaluación de la conformidad, la evaluación clínica, la transparencia y la trazabilidad.
Notificación de efectos adversos
Además, y en cumplimiento de la normativa, los productos sanitarios cuentan con el marcado CE otorgado por la Agencia Española de Medicamentos y Productos Sanitarios (Aemps), como Organismo Notificado español, o por otros Organismos Notificados designados en otros Estados Miembros de la Unión Europea, basado en un reconocimiento mutuo establecido por la legislación aprobada por las Instituciones comunitarias, el Parlamento y Consejo Europeo.
En cuanto a la vigilancia, desde la patronal explican que “cualquier incidencia con un producto sanitario debe ser comunicada a la Unidad de Vigilancia de la Aemps”, como autoridad competente en España, para que se adopten las medidas oportunas estipuladas en la legislación. Los profesionales sanitarios y las empresas del sector actúan de forma activa ante cualquier incidente.
Por todo ello, la Federación, que representa al sector de Tecnología Sanitaria, “reitera su compromiso de seguir trabajando junto con las Administraciones y los profesionales sanitarios en cualquier iniciativa que contribuya a mejorar el sistema de evaluación y seguimiento de los productos sanitarios en beneficio de la seguridad de los pacientes”.
Reducir la sensación de alarma
La Federación de Asociaciones Científico Médicas Españolas (Facme) también ha querido aclarar ciertos puntos de las informaciones publicadas por ese consorcio, “con el objetivo de reducir la sensación de alarma que puede despertarse en la opinión pública y poner en valor la excelencia de nuestro sistema sanitario”.
Facme explica que “la aplicación de nuevos medicamentos para el abordaje terapéutico o de nuevos dispositivos para el diagnóstico y el tratamiento son decididos por el profesional médico en función de máximas expectativas de seguridad, eficacia y eficiencia”.
Además, la federación de asociaciones indica que “ni los profesionales médicos ni los centros sanitarios pueden adquirir o implantar dispositivos de dudosa calidad, no autorizados, carentes de certificación europea o fuera del control sanitario”.
A pesar de todo, los médicos también recuerdan que “cualquier actividad médica conlleva cierto grado de riesgo, evaluado y aceptado siempre que el beneficio a obtener lo compense. Entre dichos riesgos están incluidos los efectos adversos de los medicamentos y productos sanitarios, que en ocasiones no se conocen hasta el uso de los productos”.















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: 