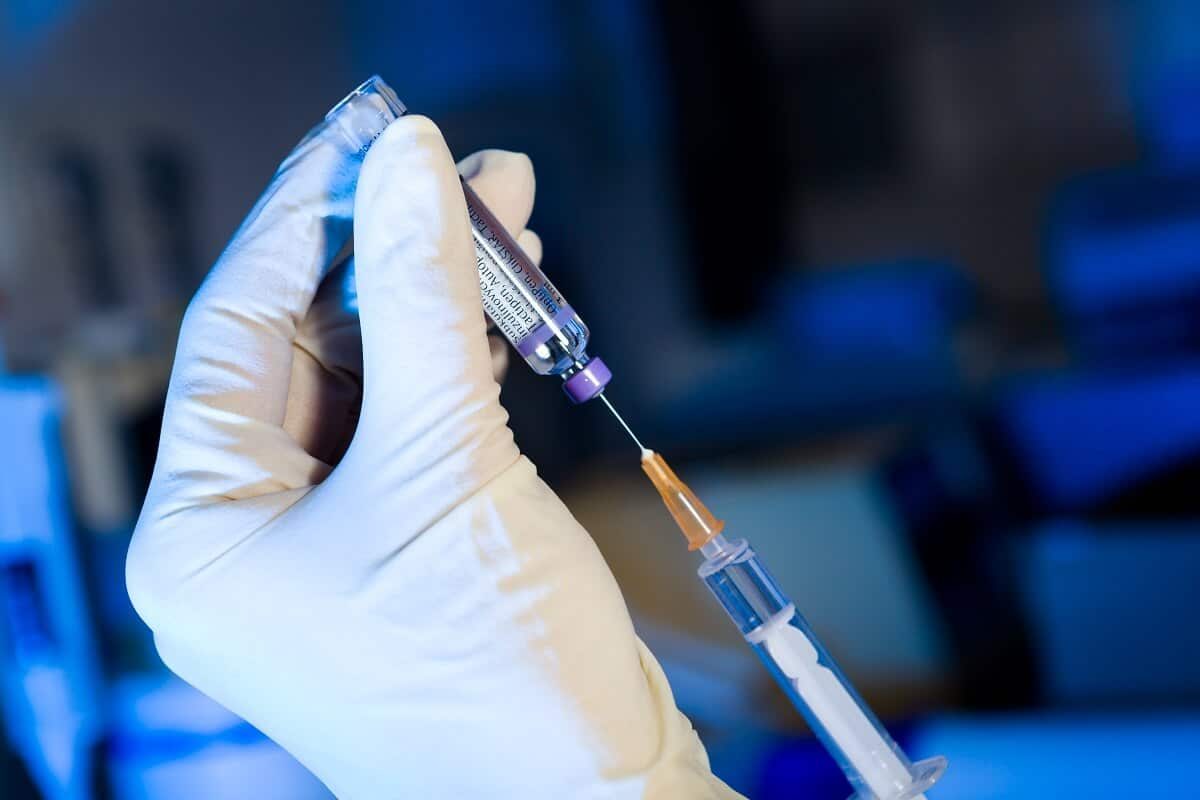
La EMA ha recomendado una autorización de comercialización en la Unión Europea (UE) para Arexvy (recombinante, adyuvada), la primera vacuna para la inmunización activa para proteger a los adultos mayores de 60 años contra la enfermedad del tracto respiratorio inferior (LRTD) causada por el virus respiratorio sincitial (VRS).
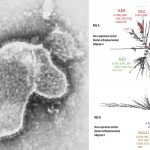
Arexvy, de GSK Biologicals contiene una versión diseñada de la glicoproteína de superficie de fusión RSV. Esta proteína es esencial para que el VRS infecte el organismo y también es el objetivo principal de los anticuerpos generados para combatir la infección. La vacuna también contiene un "adyuvante", una sustancia que ayuda a fortalecer la respuesta inmunitaria a la vacuna. Cuando una persona recibe la vacuna, su sistema inmunitario genera anticuerpos específicos y células T que ayudan a prevenir la infección.
Arexvy se evaluó según el mecanismo de evaluación acelerada de la EMA porque la prevención de la infección por VRS en la población anciana se considera de gran interés para la salud pública.
La opinión del comité de medicamentos humanos (CHMP) de la EMA se basa en datos de un ensayo aleatorizado controlado con placebo en 25.000 adultos en 17 países. Los resultados mostraron una protección estimada del 83 % contra la LRTD confirmada por RSV durante al menos seis meses. Los efectos secundarios más comunes informados fueron dolor de cabeza, cansancio, dolor muscular, dolor en las articulaciones y dolor en el lugar de la inyección.
El estudio aún está en curso y se utilizará para evaluar la eficacia de una dosis única de Arexvy durante varias temporadas y la necesidad de revacunación, y para monitorear su perfil de seguridad.
El dictamen adoptado por el CHMP es un paso intermedio en el camino de Arexvy hacia el acceso de los pacientes. El dictamen se enviará ahora a la Comisión Europea para la adopción de una decisión sobre una autorización de comercialización en toda la UE. Una vez concedida la autorización de comercialización, las decisiones sobre el precio y el reembolso se tomarán a nivel de cada Estado miembro, teniendo en cuenta el papel/uso potencial de este medicamento en el contexto del sistema nacional de salud de ese país.
















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: 