Adrián Llerena, director del Instituto Universitario de Investigación Biosanitaria de Extremadura (Inube) y presidente de la Sociedad Española de Farmacogenética y Farmacogenómica (SEFF), apunta a que, en el ámbito de la Medicina Personalizada de Precisión, “la Farmacogenómica está permitiendo seleccionar el fármaco más eficaz para cada persona y la dosis óptima, teniendo en cuenta su perfil genético y posibilitando la disminución de las reacciones adversas”. Es decir, la Farmacogenómica contribuye a la implementación de la Medicina Personalizada de Precisión.
Llerena ha realizado estas manifestaciones el seminario ‘Una mirada hacia la medicina del futuro: Farmacogenómica y Medicina Personalizada de Precisión’ organizado por la Fundación Roche y en el que se ha puesto de relevancia el papel de esta disciplina para identificar de forma previa qué tratamiento será más eficaz para cada paciente y/o qué pacientes podrían desarrollar una toxicidad inaceptable
En la inauguración del seminario, Federico Plaza, vicepresidente de la Fundación Instituto Roche, ha hecho hincapié en que “la Farmacogenómica se posiciona como una de las herramientas clave en la medicina del futuro, contribuyendo a mejorar los procesos de toma de decisiones a la hora de instaurar el tratamiento farmacológico y poniendo de manifiesto la relevancia que la Medicina Personalizada de Precisión tiene para numerosos pacientes y para el abordaje de patologías no solo oncológicas, sino también neurológicas, cardiovasculares o trastornos metabólicos como la diabetes; entre otras”.
La variabilidad en la respuesta a los fármacos se debe a la presencia de variantes genéticas en uno de cada tres casos. Estas variantes, denominadas polimorfismos, son pequeñas modificaciones en la secuencia de ADN que pueden modificar la expresión y la función de las proteínas que codifican. Dichos cambios en el ADN pueden tener efectos sobre la concentración disponible de un fármaco (la llamada farmacocinética), dicho de otro modo, estos pueden influir en el ritmo en el que el organismo lo metaboliza y elimina, así como en el mecanismo de acción del medicamento (farmacodinámica), afectando a la eficacia y la seguridad de los fármacos. Si se produce menor cantidad de proteína responsable de metabolizar un fármaco, este se eliminará de forma más lenta, acumulándose y pudiendo provocar efectos adversos más graves. Sin embargo, en el caso de que la proteína se produzca en exceso, consumirá muy deprisa el fármaco y esto disminuirá su efecto terapéutico. Además, otras variaciones pueden modificar la estructura de la proteína provocando que la unión con el fármaco no sea la adecuada y causando su inactividad.
En esta línea, resulta relevante identificar las variantes más prevalentes en la población que condicionan la respuesta a fármacos y que, por tanto, pueden emplearse como biomarcadores para predecirla, seleccionando el fármaco más adecuado, atendiendo a la identificación de dianas terapéuticas, el ajuste de dosis según el perfil de metabolización del individuo, la predicción de interacciones farmacológicas, reacciones adversas o fracasos en la respuesta.
En este sentido, María Isidoro, jefa de Servicio de Análisis Clínicos y Bioquímica Clínica del Complejo Asistencial Universitario de Salamanca y coordinadora del Plan Estratégico de Medicina Personalizada de Precisión de Castilla y León, manifiesta que “la inclusión de biomarcadores en la cartera de servicios resulta fundamental porque es una forma de disponer de un marco común que garantice la equidad en la asistencia. Debe ser una estructura flexible que se pueda adaptar a los cambios que se vayan produciendo, gracias a los avances que el conocimiento nos va permitiendo. No obstante, su ampliación debe ceñirse a aquellos marcadores en los que se demuestre una clara utilidad clínica”.
Respecto al papel de las instituciones, la especialista agrega que “es esencial la concienciación sobre la necesidad de abordar la Medicina Personalizada de Precisión, así como el apoyo de la Administración -en forma de recursos-, con el fin de poder implementar estrategias que permitan extender este abordaje al mayor número de pacientes posible.
Más allá de los factores genéticos, es necesario tener en cuenta en la variabilidad de respuesta a fármacos, los factores ambientales y el estilo de vida, ya que también pueden modificar la forma en la que se expresan los genes influyendo, por ejemplo, en la cantidad de proteína que se produce. De hecho, el estilo de vida puede modificar la respuesta a medicamentos, a través de interacciones directas como la alimentación, el tabaco o la combinación con otros fármacos.
Práctica clínica
Hasta la actualidad, la medicina clásica ha abordado la asistencia médica desde la perspectiva de la enfermedad, adoptando un enfoque terapéutico igual para todos los pacientes con un mismo diagnóstico.
Llerena señala que la Farmacogenómica, en algunos casos, ya está incluida en la cartera de servicios y explica que hay fármacos ya desarrollados con biomarcadores específicos, en el área de la oncología, pero también otras áreas como la salud mental y cardiovascular en las que ya se está aplicando. “Entre el 60% y el 70% de los fármacos que están autorizados en Europa contienen un biomarcador genético. A partir de la individualización, vamos a poder prevenir interacciones de causa farmacogenética y, sobre todo, reacciones adversas y fallos terapéuticos, optimizando recursos y contribuyendo de esta manera a la sostenibilidad del Sistema Sanitario”, expone.
Los objetivos de la Farmacogenómica velan por la personalización de los tratamientos. Más concretamente, buscan evitar que los pacientes reciban un tratamiento al que no van a responder, implementando un tratamiento farmacológico eficaz basado en sus características genómicas, al tiempo que quieren evitar toxicidades y reacciones adversas innecesarias, aumentando la seguridad de los tratamientos.
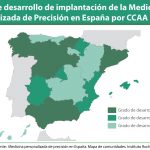
El presidente de la SEFF resalta que, en España, la Medicina Personalizada de Precisión está contemplada en las estrategias del Ministerio de Sanidad, en proyectos como el Plan Estratégico de IMPaCT, con un grupo de trabajo dedicado específicamente a la Farmacogenómica. “Estas iniciativas contribuirán a que el paciente pueda beneficiarse de la información que proporciona la Farmacogenética cuando recibe una prescripción. Nos encontramos en una situación esperanzadora”, subraya.
La coordinadora del plan estratégico de Medicina Personalizada en Castilla y León comparte, como caso de éxito, la aplicación clínica del modelo five step precision medicine (5SPM), basado en el análisis del perfil farmacogenómico de cada paciente que “ha permitido una drástica disminución en el número de ingresos de los pacientes que, en algún caso, han pasado de más de 15 ingresos anuales a ninguno, normalizando así su régimen de vida”. “Algunos pacientes que ingresaron en situación de riesgo vital se recuperaron de forma inmediata tras el análisis del perfil farmacogenético que permite identificar que la causa de su deterioro estaba relacionada con los efectos adversos producidos por interacciones farmacológicas graves”, añade.
Para Consuelo Martín de Dios, directora gerente de la Fundación Instituto Roche, “la Farmacogenómica está contribuyendo al desarrollo de nuevos fármacos más seguros y eficaces, aportando información sobre la predicción de respuesta a un fármaco, la selección del fármaco y la dosis que mejor se ajuste a las necesidades de cada paciente, basándose en su perfil genómico y, de este modo, contribuirá a optimizar los recursos y reducir el gasto sanitario”. Además, la directora gerente concluye que el papel de los medios de comunicación es “muy relevante” en el proceso de concienciación y divulgación de los avances en el campo de la salud.















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: