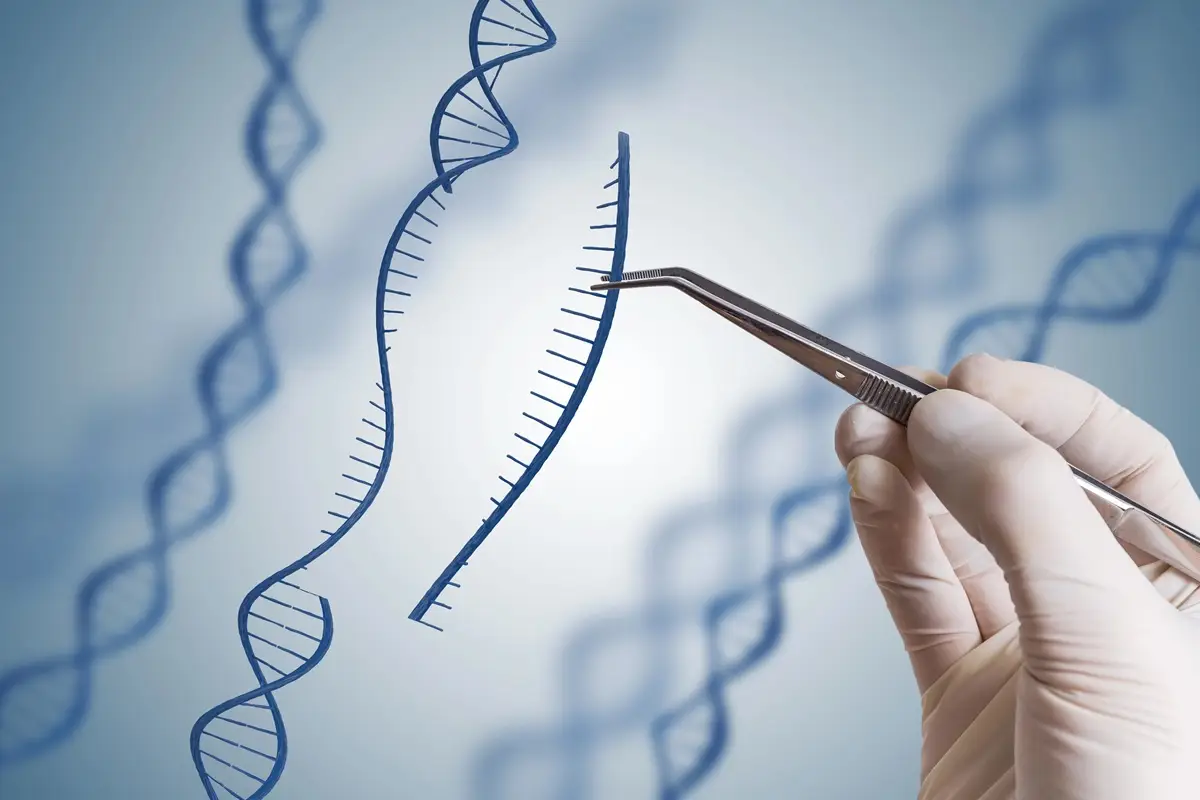
La amplificación de oncogenes constituye una de las alteraciones genómicas más relevantes en el desarrollo y la progresión de numerosos tumores sólidos. Frente a la mutación puntual, esta alteración se caracteriza por la presencia de decenas o incluso centenares de copias adicionales de un mismo gen dentro de una célula tumoral. Esta situación favorece una sobreexpresión sostenida de proteínas implicadas en proliferación, supervivencia celular y evasión de los mecanismos de control del organismo, lo que se asocia con mayor agresividad tumoral, peor pronóstico clínico y aparición de resistencias terapéuticas.
Un estudio dirigido por Sandra Rodríguez-Perales, responsable de la Unidad de Citogenética Molecular y Edición Genómica del Cáncer del Centro Nacional de Investigaciones Oncológicas, y por Raúl Torres, de la Unidad de Terapias Innovadoras del CIEMAT, plantea un cambio conceptual en el abordaje terapéutico de este fenómeno. El trabajo, publicado en Molecular Cancer, explora el uso de la edición génica como herramienta para convertir la amplificación de oncogenes en una vulnerabilidad selectiva de las células tumorales.
El enfoque se basa en una premisa sencilla. Si una célula tumoral alberga múltiples copias de un oncogén, el daño dirigido contra ese gen puede multiplicarse hasta superar la capacidad de reparación celular. Esta acumulación de roturas en el ADN desencadena mecanismos de muerte celular, mientras que las células sanas, que solo contienen una o dos copias del gen, conservan su capacidad de reparación y sobreviven al proceso.

Los investigadores utilizaron la herramienta de edición génica CRISPR-Cas9 para inducir cortes específicos en oncogenes amplificados. Según explica Rodríguez-Perales, “utilizamos la herramienta de edición génica CRISPR-Cas9 para hacer un corte en el oncogén amplificado. Normalmente, cuando una célula detecta un daño en su ADN, lo repara; pero si el gen está amplificado y existe en múltiples copias, el corte se produce en todas ellas y se acumula un nivel elevado de daño genético”. Cuando ese daño no puede repararse de forma completa, “la célula activa la maquinaria de muerte celular”.
El estudio se desarrolló en modelos celulares y animales de neuroblastoma, cáncer de pulmón de células pequeñas y cáncer colorrectal, tres patologías en las que la amplificación de oncogenes desempeña un papel relevante. En todos los casos analizados, la aplicación de esta estrategia condujo a una reducción del crecimiento tumoral y a un aumento de la supervivencia de los animales tratados.
Más allá del efecto directo sobre las células tumorales, los autores observaron cambios compatibles con la activación de una respuesta inmune antitumoral. La hipótesis del equipo es que la muerte celular inducida por daño masivo en el ADN podría actuar como señal de alarma para el sistema inmunitario, facilitando el reconocimiento del tumor y contribuyendo a un control más eficaz de la enfermedad.
Selectividad terapéutica
Uno de los principales desafíos de las terapias basadas en edición génica es lograr una selectividad suficiente para evitar efectos indeseados en tejidos sanos. En este trabajo, la selectividad no depende de una diferencia en la secuencia genética entre células tumorales y normales, sino del número de copias del gen diana. Las células sanas, al no presentar amplificación, pueden reparar los cortes inducidos sin consecuencias letales.
“Abordamos así uno de los grandes cuellos de botella de las terapias de edición génica: lograr que el corte sea selectivo, de modo que ataque a las células tumorales sin dañar a las células sanas”, señalan los autores en el artículo. Este planteamiento amplía el abanico de posibles dianas terapéuticas más allá de las mutaciones exclusivas del tumor.
La amplificación de oncogenes se detecta en una proporción relevante de tumores sólidos y, en muchos casos, se asocia con resistencia a tratamientos convencionales. Convertir esta alteración en una debilidad explotable terapéuticamente podría abrir nuevas opciones para pacientes con enfermedad refractaria.
Implicaciones para terapias de precisión
El trabajo se presenta como una prueba de concepto preclínica, pero sus implicaciones para el desarrollo de terapias de precisión resultan evidentes. La posibilidad de diseñar herramientas de edición génica dirigidas a oncogenes amplificados permitiría adaptar el tratamiento al perfil genómico específico de cada tumor.
Según los autores, “la edición génica de la amplificación en tumores puede ser una base para desarrollar terapias génicas de precisión para cánceres resistentes”. Esta aproximación encaja con la tendencia hacia una oncología cada vez más personalizada, basada en alteraciones moleculares concretas.
Además, el equipo comenzó a explorar la combinación de esta estrategia con tratamientos ya existentes. En modelos animales de neuroblastoma, la combinación de edición génica y uno de los fármacos habituales en quimioterapia provocó la muerte de un número de células superior al esperado por la suma de ambos tratamientos por separado. Este efecto sugiere una posible sinergia terapéutica, aunque los autores subrayan que estos resultados se limitaron a modelos preclínicos.
Respuesta inmune antitumoral
Otro de los aspectos con implicaciones terapéuticas es la posible activación del sistema inmunitario. La muerte celular inducida por daño masivo en el ADN podría generar señales inmunogénicas capaces de atraer y activar células del sistema inmune.
En los experimentos realizados, el equipo detectó indicios iniciales de esta activación, lo que abre una línea de investigación futura. Profundizar en esta respuesta permitiría evaluar la combinación de edición génica con estrategias de inmunoterapia, un campo en expansión en oncología.
Los autores indican que continuarán investigando este mecanismo en trabajos posteriores, con el objetivo de determinar si la respuesta inmune observada puede potenciarse y contribuir de forma significativa al control tumoral.
Resultados preclínicos y límites
Pese al potencial terapéutico que sugieren los resultados, los investigadores subrayan que el estudio se limita a modelos celulares y animales. La traslación clínica de la edición génica en oncología plantea retos técnicos, regulatorios y de seguridad que deberán abordarse antes de su aplicación en pacientes.
Entre estos retos se encuentran la eficiencia de la entrega de los sistemas de edición génica al tumor, el control de posibles efectos fuera de diana y la evaluación a largo plazo de la seguridad del tratamiento. No obstante, el trabajo aporta una base conceptual sólida para explorar estas cuestiones.
Alejandro Nieto y Marta Martínez-Lage, co-primeros autores del estudio, afirman que “el estudio demuestra una estrategia novedosa basada en CRISPR que convierte la amplificación de oncogenes en una vulnerabilidad, desencadenando la muerte únicamente de las células tumorales”. En su opinión, este enfoque “podría abrir una vía hacia terapias de precisión para tumores difíciles de tratar”.















 Lilisbeth Perestelo:
Lilisbeth Perestelo:  César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):