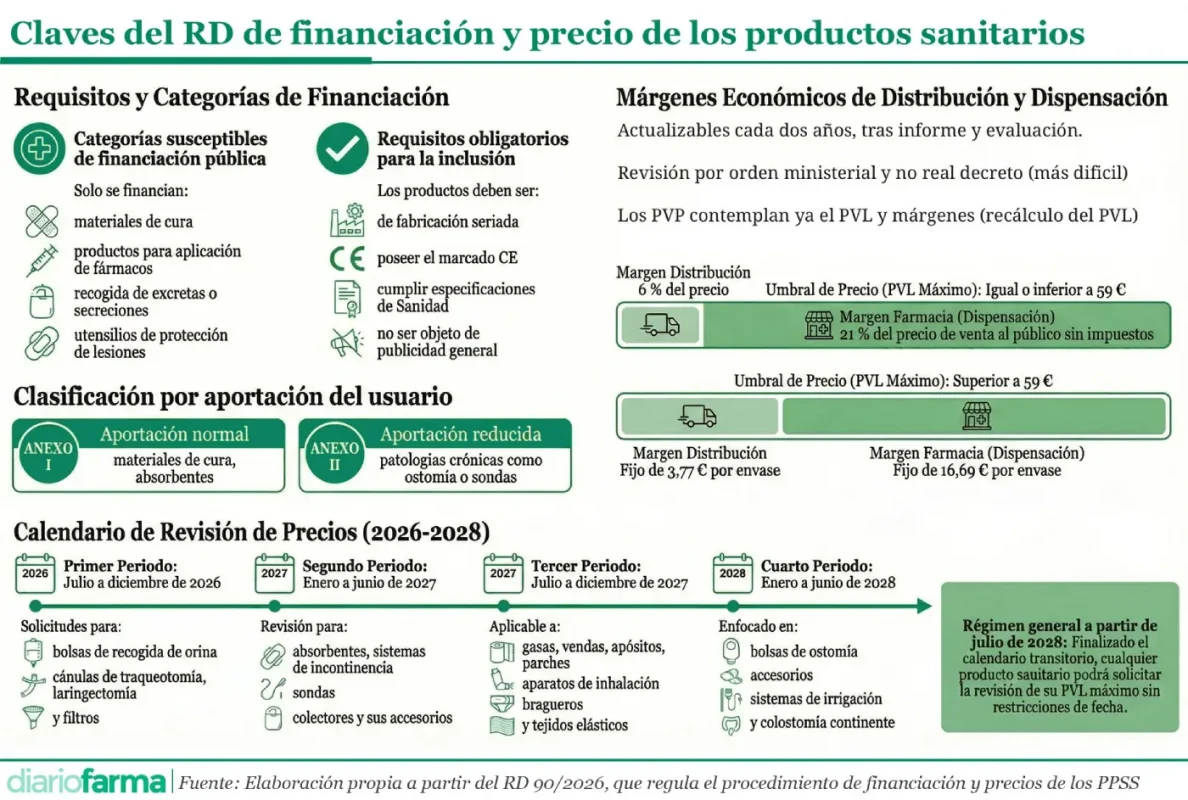
El Boletín Oficial del Estado (BOE) ha publicado este jueves el Real Decreto 90/2026, que regula el procedimiento de financiación y fijación de precios de los productos sanitarios incluidos en la prestación farmacéutica del Sistema Nacional de Salud (SNS) para pacientes no hospitalizados, aprobado por el último Consejo de Ministros. Entre las principales novedades del real decreto figura la fijación, por primera vez, de los márgenes de distribución y dispensación, con un 21% para las oficinas de farmacia y un 6% para los distribuidores.
La regulación de márgenes y sus cuantías ya se recogía así en el texto sometido a alegaciones, pero la versión definitiva vigente incorpora un sistema de actualización más flexible, mediante orden ministerial, previo acuerdo de la Comisión Delegada del Gobierno para Asuntos Económicos (CDGAE) y no por real decreto como estaba en la versión anterior. Esta modificación permitirá que el Ministerio de Sanidad pueda modificar los márgenes de forma más sencilla y rápida.
Este es uno de los principales cambios identificados por Diariofarma, que ha comparado el texto sometido a alegaciones con la versión finalmente publicada en el BOE. Otros cambios relevantes afectan al marco económico, al calendario de revisiones, a las obligaciones de información del sector y a las condiciones de dispensación.
El real decreto establece que el precio de los productos sanitarios financiados se construirá a partir del precio industrial máximo (PVL) fijado por la Comisión Interministerial de Precios, al que se añadirán los márgenes de distribución y dispensación y los impuestos correspondientes. Se trata de un modelo idéntico al de los medicamentos.
Las cuantías de estos márgenes se recogen en el anexo IV de la norma. En el caso de las oficinas de farmacia, además de los márgenes generales ya indicados, se ha marcado un margen fijo para los productos con un PVL superior a 59 euros. En concreto, se establece un margen fijo para distribución de 3,77 euros y de 16,69 euros por envase para la oficina de farmacia. Se trata de la primera vez que el régimen de márgenes para productos sanitarios financiados se regula de forma expresa en una norma específica.
La norma establece que el Ministerio elaborará cada dos años un informe sobre la evolución de precios y márgenes que podrá incluir propuestas de actualización, lo que podría dar lugar a modificaciones en ellos, algo que con la nueva configuración legal sería más sencillo.
Calendario de actualización por grupos
Otro de los cambios de mayor impacto es la introducción de un calendario obligatorio por grupos de producto para la revisión al alza de precios y la solicitud de nuevas inclusiones.
Las empresas que ya tengan productos financiados deberán ajustarse a un calendario que se desarrollará entre julio de 2026 y junio de 2028, con cuatro periodos diferenciados según el tipo de producto. Una vez finalizado el último periodo, las solicitudes podrán presentarse sin limitación temporal.
El mismo esquema se aplicará a las nuevas solicitudes de inclusión, que también deberán respetar las ventanas establecidas para cada grupo, salvo en casos excepcionales justificados por razones de interés sanitario.
Este modelo no figuraba con este nivel de detalle en el texto sometido a alegaciones y supone un cambio relevante en la gestión del acceso y la revisión de precios, al limitar temporalmente la capacidad de las empresas para iniciar procedimientos.
Sistema de información económica
El texto final también incorpora una nueva disposición adicional que refuerza las herramientas de seguimiento económico de la Administración. De acuerdo con el real decreto, el Ministerio de Sanidad podrá recabar de los ofertantes y distribuidores información sobre precios y volúmenes de venta, descuentos aplicados, fechas de suministro y destinatarios de los productos, incluidos centros sanitarios u oficinas de farmacia. Es algo que también se realiza con los medicamentos.
La norma señala que la información deberá limitarse a la disponible en el curso ordinario de la actividad y que el sistema se desarrollará de forma progresiva, con el objetivo de que en el plazo de dos años el Ministerio disponga de datos homogéneos suficientes para el análisis de la evolución del mercado. Adicionalmente, solicitará la información pertinente a los fabricantes.
Este mecanismo está vinculado al informe bienal sobre precios y márgenes y refuerza la capacidad de la Administración para evaluar el comportamiento económico real de los productos sanitarios financiados.
Cálculo del PVP
El real decreto introduce también un cambio conceptual en el sistema de precios, al situar el PVL máximo como referencia central del modelo. La Comisión Interministerial de Precios fijará este precio industrial con carácter máximo, mientras que el precio de venta al público se determinará posteriormente mediante la agregación de los márgenes y los impuestos.
En el caso de los productos ya financiados, la norma establece un mecanismo transitorio por el que el nuevo PVL se calculará a partir del precio anterior sin impuestos, descontando los márgenes fijados. Esto supondría que la industria deberá absorber, en función de los márgenes existentes en la actualidad, que son libres, la parte en que se incremente la retribución de distribución y farmacia.
Este enfoque sustituye la lógica previa centrada en el precio final y refuerza el control sobre el componente industrial del precio, que pasa a ser el elemento principal de evaluación y revisión.
Otro de los cambios introducidos en el texto aprobado es la eliminación de una cláusula que impedía la revisión de precio antes de que haya transcurrido un año desde la anterior. Esta cuestión se recogía en el texto sometido a alegaciones, pero se ha eliminado en el texto final, con lo que se podrá revisar el precio de un producto sanitario tantas veces como considere la Administración, independientemente del tiempo transcurrido desde la previa.
Documentación para la fijación de precio
El real decreto también recoge que, en el plazo de doce meses desde la entrada en vigor, se desarrollarán los “criterios específicos a aplicar en la evaluación de las solicitudes de inclusión” de productos sanitarios en la prestación farmacéutica para su financiación por el Sistema Nacional de Salud, así como en la fijación del precio de financiación por parte de la Comisión Interministerial de Precios de los Medicamentos. Estos criterios deberán ser aceptados por la CDGAE mediante informe.
Llama la atención que, aunque el título del real decreto indique que se va a regular la “financiación selectiva” de productos sanitarios, a lo largo de todo el texto aprobado no aparece más veces ese término. Es más, la única ocasión en que aparecía en el borrador sometido a alegaciones, se ha eliminado. El apartado 1 del artículo 3 recogía que la financiación de productos sanitarios “se producirá de forma selectiva y no indiscriminada y con rigurosa exigencia de los criterios establecidos en los artículos 92.6 y 94.1 del texto refundido de la Ley de garantías”. Todo ese apartado ahora ha desaparecido.
El texto final también refuerza el contenido económico que deben presentar las empresas en las solicitudes de inclusión. Entre la documentación exigida se incluye una propuesta justificada del PVL máximo que deberá incorporar información sobre el impacto presupuestario, la justificación de las diferencias de precio respecto a alternativas financiadas, los costes de producción y la previsión de ventas durante los tres primeros años.
Asimismo, se requiere información sobre la situación y el precio del producto en otros Estados miembros de la Unión Europea, así como datos que permitan evaluar la calidad, la usabilidad y las mejoras comparativas frente a otras opciones disponibles.
Estas exigencias no aparecían con el mismo nivel de detalle en el borrador y refuerzan el carácter económico del procedimiento de financiación.
Dispensación y canal
El texto final introduce también un cambio de redacción en el artículo relativo a la dispensación que puede tener implicaciones sobre el canal de suministro.
Mientras que la versión sometida a alegaciones establecía que la dispensación de los productos incluidos en la prestación farmacéutica debía realizarse “en todo caso por oficinas de farmacia”, el texto definitivo señala que esta obligación se aplica únicamente a los productos cuya dispensación no se realice con cargo al SNS.
Esta redacción se combina con la previsión, incluida en el artículo sobre inclusión, de que los productos financiados puedan ser suministrados o entregados a los pacientes a través de centros o servicios sanitarios o sociosanitarios bajo la tutela de las administraciones sanitarias.
El cambio introduce una mayor flexibilidad en el modelo de provisión para los productos financiados, mientras que mantiene la dispensación en oficina de farmacia para los casos en que no exista financiación pública en el acto, pero abre la puerta de manera relevante a la dispensación generalizada en centros sanitarios.
Entrada en vigor progresiva
El real decreto entrará en vigor el 1 de julio de 2026, aunque la aplicación efectiva de los nuevos márgenes y del PVL para los productos ya incluidos se realizará de forma progresiva, coincidiendo con las fechas previstas en el calendario por grupos.
Además, los productos que estaban financiados conforme a la normativa anterior y que no figuren en los nuevos anexos quedarán excluidos de la financiación transcurridos tres meses desde la entrada en vigor.
La norma deroga el Real Decreto 9/1996 y actualiza el marco regulador de los productos sanitarios financiados para adaptarlo al texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios.















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: