Omakase Consultig, empresa de consultoría estratégica, ha elaborado un informe que, bajo el título 'European Commission approved Orphan Drugs between 2012 & 2016. Analysis of P&R situation in Spain', para analizar la situación de los medicamentos huérfanos en nuestro país, en lo que respecta al acceso y, sobre todo, a las condiciones de autorización de comercialización y fijación de precio y financiación. Como principal conclusión, el documento destaca que, aun condicionados por aspectos clínicos, económicos e institucionales, los procesos de aprobación han mejorado en España en los últimos años y con ello se han reducido, con carácter general, los tiempos de incorporación al mercado.
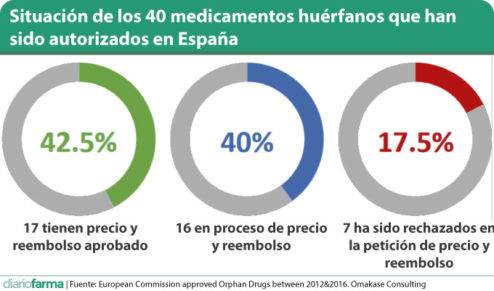
Primeramente, el informe recoge una comparación de España con el resto de la Unión Europea. Así, de los fármacos aprobados por la Comisión Europea en el periodo descrito, un total de 40 ya tenían autorización de comercialización en nuestro país al cierre del análisis, lo que representa un 70,2%. De esos 40, 17 (42,5%) contaban ya con aprobación de precio y financiación; 16 (40%) estaban aún en proceso, y a 7 (17,5%) se les había denegado el reembolso, de los cuales sólo uno, Nexobrid, se estaba comercializando en el mercado privado.
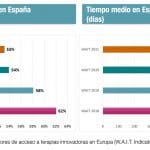
En cuanto a los tiempos, el documento de Omakase habla de una "clara tendencia" a la reducción del periodo comprendido entre la aprobación por la CE y la autorización de la Aemps, desde los 17-20 meses en 2012 a los 1,3-2 meses en 2016. En lo que respecta al tiempo que transcurre entre la aprobación de la CE y la asignación de reembolso en España, éste variaba en 2016 entre los 11 y los 20 meses, aproximadamente. El análisis concluye que, de media, desde la aprobación de un medicamento huérfano por parte de la Aemps hasta que éste obtiene reembolso en España transcurrían, de media, entre 10 y 18 meses. Por último, cabe destacar que, de media, el tiempo que transcurre entre la aprobación de la Aemps y la decisión de rechazar la financiación de un fármaco de estas características podía ir de los 3 a los 13 meses.
A la hora de determinar las variables clínicas que, según Omakase, se percibieron en el análisis del periodo descrito, cabe resaltar que 18 de los 40 fármacos autorizados (un 45%) estaban indicados para alguna enfermedad oncológica (10 con precio y reembolso aprobado); que en 24 de los casos existían alternativas terapéuticas; que 13 de ellos iban dirigidos a enfermedades ultra-raras (4 con precio y reembolso aprobado), y 24 a raras, y que 23 de esas moléculas tenían un resultado clínico directo sobre la patología (13 con precio y reembolso aprobado), mientras que en 11 casos era menos directo y en 6 indirecto.
Yendo a las variables institucionales, los autores del estudio encontraron que en 21 de los 40 casos las autoridades españolas disponían de un informe de posicionamiento terapéutico, con opiniones positivas en 17 de ellos (15 de ellos reembolsados) y negativas en 4. Otros 11 estaban en pleno proceso de elaboración y había 8 que, habiendo sido aprobados por la Comisión en el periodo 2012-2013, no disponían de dicho informe.
Comparación con otros países
Por último, destacan, entre las variables económicas, el hecho de que 37 de los 40 medicamentos autorizados fueron reembolsados en Alemania (país donde hay que recordar que se financian el primer año con precio libre), 19 en Italia, 17 en Reino Unido y 8 en Francia, lo que indica que, salvando al país germano, España estaría bien posicionado con respecto al resto de países con mayores ingresos de la Unión. También hacen referencia a la participación de los laboratorios titulares en el Plan Profarma, destacando que 18 sí lo estaban y los 22 restantes no.
Para finalizar, los autores del informe concluyen, tras su análisis, que los medicamentos huérfanos con un perfil más favorable para ser financiados por el SNS son aquellos "con un impacto clínico directo en la enfermedad y que cuenten con titulares de comercialización que participan en el Plan Profarma". También destacan la falta de transparencia en lo que respecta a la información sobre el precio de los medicamentos huérfanos en España, señalando que, si se atiende a la información disponible, "España contaría con los precios más altos de Europa". "Los precios reales acordados no son transparentes y los precios de lista no reflejan el precio real tras la negociación, que puede terminar con una rebaja superior al 50% sobre el de lista", culminan.
















 Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia:  Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados:
Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados: