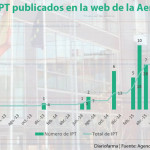
El grupo coordinador de la REvalMed ha finalizado los informes de Blincyto (blinatumomab) en adultos en monoterapia para el tratamiento de leucemia linfoblástica aguda (LLA) de precursores B CD19 positivo y en situación refractaria o en recaída, Vazkepa (icosapento de etilo) en la reducción del riesgo de eventos cardiovasculares en pacientes adultos tratados con estatinas con riesgo cardiovascular alto, Bylvay (odevixibat) en colestasis intrahepática familiar progresiva (CIFP), Tepmetko (tepotinib) en el tratamiento de pacientes adultos con cáncer de pulmón no microcítico (CPNM) avanzado, Inbrija (levodopa) en el tratamiento intermitente de fluctuaciones motoras episódicas (episodios OFF) en pacientes adultos con enfermedad de Parkinson (EP) e Imfinzi (durvalumab) en el tratamiento de primera línea de adultos con cáncer de pulmón microcítico en estadio extendido (CPM-EE).
En su última reunión, celebrada 28 de julio, ha acordado empezar a trabajar en los Informes de Posicionamiento Terapéutico (IPT) de vutrisiran, voclosporina, tirzepatida, fosdenopterina, relatlimab / nivolumab, teclistamab, tezepelumab y faricimab, que cuentan con una opinión positiva del comité evaluador de la EMA (CHMP).
Amvuttra (vutrisiran), de Alnylam Netherlands, está indicado para el tratamiento de la amiloidosis hereditaria por transtiretina (ATTRh) en pacientes adultos con polineuropatía en estadío 1 o 2. Lupkynis (voclosporina), de Otsuka Pharmaceutical Netherlands, está indicado en combinación con micofenolato de mofetilo para el tratamiento de pacientes adultos con nefritis lúpica activa clase III, IV o V (incluidas las clases mixtas III/V y IV/V). Mounjaro (tirzepatida), desarrollado por Eli Lilly Nederland, indicado para el tratamiento de adultos con diabetes mellitus tipo 2 no suficientemente controlada, como complemento de la dieta y el ejercicio, tanto en monoterapia, cuando la metformina no se considera apropiada debido a intolerancia o contraindicaciones como añadido a otros medicamentos para el tratamiento de la diabetes.
Nulibry (fosdenopterina), de Comharsa Life Sciences, está indicado para el tratamiento de pacientes con deficiencia de cofactor de molibdeno tipo A. Opdualag (relatlimab / nivolumab) ha sido desarrollado por Bristol-Myers Squibb Pharma EEIG, y está indicado para el tratamiento de primera línea de melanoma avanzado (irresecable o metastásico) en adultos y adolescentes de 12 años y mayores con expresión de PD-L1 < 1% en células tumorales.
Tecvayli (teclistamab), de Janssen-Cilag International, es un tratamiento en monoterapia para el tratamiento de pacientes adultos con mieloma múltiple en recaída y refractario, que han recibido al menos tres tratamientos previos, incluido un agente inmunomodulador, un inhibidor del proteasoma, y un anticuerpo anti-CD38 y que han presentado progresión de la enfermedad al último tratamiento.
El titular de Tezspire (tezepelumab) es AstraZeneca. El fármaco está indicado como tratamiento de mantenimiento adicional en adultos y adolescentes de 12 años y más con asma grave que no están adecuadamente controlados a pesar de la administración de corticosteroides inhalados a dosis altas en combinación con otro medicamento para el tratamiento de mantenimiento.
Vabysmo (faricimab), de Roche tiene indicación para el tratamiento de pacientes adultos con degeneración macular asociada a la edad neovascular (exudativa) y alteración visual debida a edema macular diabético.
El grupo realizará los IPT para las nuevas indicaciones o extensiones de indicación de Imcivree (setmelanotida), Retsevmo (selpercatinib), Tecartus (brexucabtagene autoleucel) y Ultomiris (ravulizumab).
De acuerdo a lo establecido en el Plan REvalMed, se realizarán todos los IPT acordados, aplicando para su priorización los criterios aprobados por la Comisión Permanente de Farmacia.
Asimismo, se acuerda iniciar a modo de piloto el siguiente IPT de acuerdo al nuevo procedimiento del Plan REvalMed: Tezspire (tezepelumab).
De manera general, no se realizarán IPTs de combinaciones de principio activos ya autorizados, salvo en los casos en los que el GC considere.
El GC recuerda que, con el fin de maximizar los recursos disponibles, y en tanto se establece un procedimiento definitivo, se solicita a los titulares de autorización de medicamentos que cuenten con una opinión positiva del CHMP, que contacten con el secretariado del grupo, en las siguientes direcciones de correo gcpt@aemps.es y revalmed.SNS@sanidad.gob.es, indicando su intención o no de comercialización en España de los nuevos medicamentos que hayan obtenido opinión positiva por procedimiento centralizado de manera prospectiva desde la publicación de este documento, y proporcionando además un punto de contacto del titular para los aspectos relacionados con el GC. En caso de no recibirse confirmación de comercialización, no se comenzará la elaboración del informe.
Del mismo modo, en caso de producirse retiradas de la autorización de comercialización, cambios de titularidad del medicamento o de la intención de comercialización del mismo, la información deberá comunicarse a las direcciones de correo indicadas anteriormente.
La próxima reunión del GC tendrá lugar el 22 de septiembre de 2022.













 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: