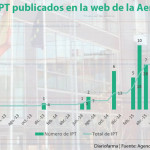
La Agencia Española del Medicamento ha publicado este lunes el contenido de la reunión del Grupo Coordinador REvalMed SNS (GC), en fecha 21 de diciembre en la que se ha acordado empezar a trabajar los Informes de Posicionamiento Terapéutico (IPT) de tres medicamentos con una opinión positiva del CHMP.
Dichos medicamentos son Hemgenix (etranacogene dezaparvovec), de CSL Behring GmbH, para el tratamiento de la hemofilia B (deficiencia congénita del factor IX) grave y moderadamente grave en pacientes adultos sin antecedentes de inhibidores del factor IX. Imjudo (tremelimumab), de AstraZeneca AB, en combinación con durvalumab está indicado para el tratamiento de primera línea de pacientes adultos con carcinoma hepatocelular avanzado o irresecable. Y Tremelimumab AstraZeneca (tremelimumab), de AstraZeneca AB, en combinación con durvalumab y quimioterapia basada en platino está indicado para el tratamiento de primera línea de pacientes adultos con cáncer de pulmón no microcítico (CPNM) metastásico sin mutaciones sensibilizantes de EGFR o mutaciones ALK.
Igualmente, se ha acordado iniciar a modo de piloto el IPT de acuerdo al nuevo procedimiento del Plan REvalMed: Imjudo.
Finalmente, el GC de la REvalMed ha finalizado los informes de Inrebic (fedratinib) en el tratamiento de la esplenomegalia o los síntomas relacionados con la enfermedad en pacientes adultos con mielofibrosis primaria, mielofibrosis posterior a policitemia vera o mielofibrosis posterior a trombocitemia esencial que no han recibido inhibidores de la cinasa asociada a Janus (JAK) previamente o han recibido tratamiento con ruxolitinib, Keytruda (pembrolizumab) en cáncer de endometrio con MSI-H o dMMR avanzado o recurrente que ha progresado durante o después de un tratamiento previo basado en platino, en cualquier contexto, y que no son candidatas a cirugía curativa o radioterapia, Keytruda® (pembrolizumab) en cáncer colorrectal con MSI-H o dMMR irresecable o metastásico después de quimioterapia de combinación previa basada en fluoropirimidina, Retsevmo (selpercatinib) en cáncer de pulmón no microcítico (CPNM) avanzado, con fusión del gen RET positiva no tratados previamente con un inhibidor RE, Tecentriq (atezolizumab) en el tratamiento adyuvante tras resección completa y quimioterapia basada en platino para pacientes adultos con CPNM con alto riesgo de recidiva, cuyos tumores expresen PD-L1 ≥ 50% en células tumorales que no presentan mutaciones de EGFR o ALK positivo, Xeljanz® (tofacitinib) en espondilitis anquilosante (EA) activa que han respondido de forma inadecuada al tratamiento convencional, Keytruda (pembrolizumab) en el tratamiento adyuvante en adultos y adolescentes a partir de 12 años de edad con melanoma en estadio IIB, IIC o III y que hayan sido sometidos a resección completa, Keytruda (pembrolizumab) en combinación con quimioterapia basada en platino y fluoropirimidina, en el tratamiento de primera línea del carcinoma de esófago o adenocarcinoma de la unión gastroesofágica HER-2 negativo localmente avanzado irresecable o metastásico, en adultos cuyos tumores expresen PD-L1 con una CPS ≥ 10, Vydura (rimegepant) en el tratamiento agudo de la migraña y en el tratamiento preventivo de la migraña episódica y de Vyepti® (eptinezumab) en la profilaxis de la migraña.
















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: