Pese a que España se ha convertido en los últimos años (más si cabe tras las aprobación del Real Decreto de Ensayos Clínicos) en un centro de referencia para la investigación clínica que realizan las compañías farmacéuticas de capital extranjero, dada la buena reputación de nuestros hospitales y nuestros investigadores, no abundan aún las que han traído a nuestro país sus centros de I+D, es decir, las que comienzan dentro de nuestras fronteras el proceso de descubrimiento y desarrollo inicial de los nuevos fármacos. Tanto es así, que se pueden contar con los dedos de una mano.

Eso le da más valor, si cabe, al hecho de que Lilly anunciara hace unos meses la aprobación, por parte de la Agencia Americana de Medicamentos (FDA), de abemaciclib, un nuevo fármaco para el tratamiento del cáncer de mama con receptores hormonales positivos (HR+) y receptor 2 de factor de crecimiento epidérmico humano negativo (HER2-) en dos indicaciones diferentes. La compañía la calificó como la molécula made in Spain, por el hecho de que es resultado de la investigación que se hace en el centro de I+D que tiene en Alcobendas, Madrid, desde 2002. Años más tarde, en 2009, se le adhirió el Laboratorio Europeo de Bioquímica y Biología Molecular, y con él Lilly se ha convertido en una de las pocas farmacéuticas extranjeras que cubren todo el proceso de desarrollo de fármacos en nuestro país, abarcando diversas áreas terapéuticas.
María José Lallena, directora del área de Biología del Centro de I+D de Lilly España, explica el curso que se ha seguido con abemaciclib: "En 2008 tuvo lugar la declaración de candidato. Hasta entonces se habían invertido tres años de investigación. La aprobación de la FDA ha tenido lugar en 2017, por lo que su desarrollo ha durado nueve años". Un desarrollo que ha tenido a España como protagonista, ya que aquí se han realizado estudios en fase II y III que han servido posteriormente para su aprobación por la FDA y para el envío del dossier a la EMA. Además, se está analizado también su posible aplicación en cáncer de pulmón y páncreas.
En total, España ha participado o participa (hay algunos que siguen activos) en 13 estudios, que han involucrado a 90 equipos de investigación y a 300 pacientes, a los que se sumarán otros 200 en 2018. "La investigación clínica con abemaciclib se ha realizado y se continúa realizando en España", subraya Lallena, quien, más allá del descubrimiento de este fármaco, pone en valor los "importantes beneficios, en términos de conocimiento, que se están generando en nuestro país". "Algunos centros de investigación españoles que han participado en los estudios han tenido una comunicación muy fluida con nosotros y se ha producido un intercambio de información constante con el centro de I+D", prosigue. Y añade: "Con la aparición de un fármaco, cuyas primeras fases se han desarrollado en España, se apoya el mensaje de que la investigación en nuestro país es de altísima calidad y alcanza los mejores niveles que pueda haber en cualquier parte del mundo".
No obstante, no prevé que esto vaya a suponer un aumento de las inversiones o los puestos de trabajo en Alcobendas. Y es que, dice, "Lilly apuesta por el Centro de I+D de España por el nivel de sus científicos, porque tenemos uno de los mejores sistemas nacionales de salud del mundo y por la calidad de la investigación que se desarrolla", independientemente de que los proyectos salgan adelante o no, "ya que los fracasos también son parte del proceso de investigación y generan conocimiento, y son necesarios para luego alcanzar el éxito".
Un centro especializado en enfermedades de países en desarrollo
Junto a las instalaciones de Lilly en Alcobendas, cabe destacar el Diseases of the Developing World, un centro creado en 2001 por GlaxoSmithKline en Tres Cantos, Madrid, y que está enfocado al descubrimiento y desarrollo inicial de fármacos para enfermedades de países en desarrollo, con base en las necesidades establecidas por organismos internacionales, sin que eso reporte retornos económicos para la compañía. Pese a ello, la inversión en estas instalaciones fue de 30 millones de euros en 2016. Para su labor, además, se apoyan en investigadores expertos ajenos a la organización. En total, hay 120 investigadores trabajando en este centro, entre propios y externos.

Como indica José Miguel Coterón, responsable científico de la Unidad de Kinetoplástidos del DDW, la I+D que en él se realiza se dirige al descubrimiento de nuevas soluciones, principalmente, para malaria, tuberculosis y enfermedades causadas por kinetoplástidos (como Leishmaniasis visceral, chagas o enfermedad del sueño), "que son algunas de las más prevalentes en estos países". Para ello, añade, existen "tres unidades de descubrimiento de fármacos (DPU o Discovery Performance Unit en inglés), cuya misión abarca desde la identificación de la diana, pasando por el screening, identificación y optimización de hits y leads, obtención de candidatos a desarrollo, fase pre-clínica y estudios de fase I hasta la investigación clínica en fase II o prueba de concepto".
El hecho de que el objetivo no sea el retorno económico facilita la aplicación de un enfoque de innovación abierta, que, apunta Coterón, se basa en tres pilares. El primero, Patent Pool, que implica patentar para poder trabajar con esas moléculas sin que cualquier otro interesado que pueda buscar retornos lo impida. "Esas patentes pueden ser licenciadas gratuitamente para investigar y están disponibles en la base de datos pública WIPO Re:Search", subraya. El segundo, Open Source, basado en las pruebas de la colección de casi dos millones de compuestos de GSK frente a ensayos biológicos para identificar moléculas activas frente a los parásitos y la publicación de las estructuras de los positivos mediante artículos en revistas científicas y bases de datos públicas. "Por ejemplo, en 2010 se publicaron en Nature las estructuras de más de 13.500 moléculas con actividad frente a Plasmodium falciparum, el parásito responsable de la malaria", continúa. Y, por último, OpenLab, un laboratorio abierto a investigadores ajenos a GSK que tengan una idea o un proyecto en línea con estas enfermedades y no tenga instalaciones o recursos. Se les permite trabajar en el DDW codo con codo con los investigadores GSK, con financiación de la Tres Cantos Open Lab Foundation.
El resultado de toda esta labor de I+D ha cristalizado en varias moléculas. En estos casos, explica el responsable científico, "el DDW es responsable de las fases I y II, aunque los ensayos clínicos correspondientes se realizan en centros de diferentes países, normalmente en centros hospitalarios o clínicas, decidiéndose el más adecuado caso por caso y teniendo en cuenta que la prevalencia de la enfermedad sea suficiente para poder reclutar pacientes". Concretamente, de aquí han salido tafenoquina, para malaria, que está en fase III, así como una molécula en fase I y tres moléculas en estudios preclínicos.
Citre: el único centro de I+D de Celgene en Europa
En este reducido grupo de empresas farmacéuticas que decidieron en su día localizar una parte de su I+D en España se encuentra Celgene, que implantó en Sevilla, en 2011, el Celgene Institute for Translational Research Europe (Citre), su primer centro de investigación fuera de los Estados Unidos. En él han invertido más de 30 millones de euros hasta 2016, año en el que se incrementó la cuantía en cuatro millones de euros con respecto al ejercicio anterior. "Eso muestra", aseguran, "nuestra apuesta por España como región principal de desarrollo de I+D fuera de Estados Unidos".

Básicamente, la Unidad de Investigación Clínica de Citre está especializada en la gestión, diseño y administración de ensayos clínicos enfocados al estudio del cáncer, englobando tumores sólidos y de tipo hematológico, así como enfermedades raras (en un futuro inmediato se plantean explorar otras áreas terapéuticas como inflamación e inmunología). En 2017 han tenido en cartera 13 ensayos, liderando la gestión en ocho de ellos, tanto en Europa como en Estados Unidos y Canadá, y habiendo sido responsables del diseño de tres. Para la ejecución de los mismos, además, han contactado o colaborado con hasta nueve centros de investigación de Andalucía y otros tantos del resto de España.
Mirando al futuro, desde Celgene España aseguran que "Citre reúne los requisitos internos adecuados para poder gestionar y absorber un número creciente de ensayos clínicos, ya que cuenta con personal altamente cualificado y una plantilla en expansión. Además, está implementando una serie de iniciativas destinadas a la optimización de procesos que incrementan la eficiencia en la ejecución de estudios y que han contribuido decisivamente a dar visibilidad europea en los ensayos en fase temprana dentro de la compañía".
En lo que respecta a la colaboración con centros españoles en investigación preclínica, cabe destacar que la Unidad de Investigación Clínica de Citre está involucrada en dos grandes proyectos con la Universidad de Navarra: 'New Insights into the Mechanism of Action (MoA) of First-in-Class IgG-Based Bcma T-Cell Bispecific Antibody (TCB) for the Treatment of Multiple Myeloma (MM)', publicado en la revista Blood Journal, que describe la prometedora actividad preclínica del first-in-class IgG-based BCMA-TCB (antígeno de maduración de células B para la Tuberculosis basado en Inmunoglobulina G), y otro que se basa en el estudio de la actividad preclínica y farmacocinética del anticuerpo biespecífico EM801 de BCMA de Células T para el tratamiento del mieloma múltiple, que ha permitido la identificación de antígeno de maduración de células B (BCMA) como un objetivo potencialmente terapéutico. "Estas colaboraciones han facilitado el diseño de novedosos ensayos first in human focalizados en la indicación de mieloma múltiple, que se gestionarán desde la Unidad de Investigación Clínica de Citre. Está previsto que ambos ensayos se lleven a cabo en España, entre otros países, previa aprobación de los comités y autoridades competentes", culminan.
Janssen lleva investigando desde 1985 en Toledo
Por último, cabe destacar el Centro de Investigación Básica de Janssen en Toledo, uno de los cinco centros de Drug Discovery con los que cuenta la división biofarmacéutica de Johnson & Jonhson (dos de ellos están en Estados Unidos y tres Europa). Según indican en su web, en estas instalaciones, creadas en 1985, "siempre se trabaja en estrecha coordinación y colaboración con el resto de centros de investigación y en especial con la casa central europea en Beerse (Bélgica)".
Su misión consistiría en diseñar y sintetizar nuevas moléculas con potencial interés biológico, principalmente dentro del área del sistema nervioso central y en especial en psicosis, depresión, demencias y enfermedad de Alzheimer. "Los productos así preparados son enviados a la casa central en Beerse (Bélgica) donde se les somete a toda una batería de ensayos farmacológicos, in vitro, ex vivo e in vivo para confirmar, analizar y optimizar las actividades biológicas en un proceso iterativo, que de resultar positivo nos conduce a la selección de un producto final para su desarrollo a nivel de estudios clínicos", explican. Al parecer, de este centro podrían haber salido hasta 14 compuestos, alguno de ellos incluso alcanzando la comercialización, aunque no se ha podido confirmar el dato con la compañía.









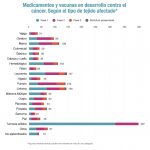









 :
:  Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados:
Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados:  Margarita de la Pisa, eurodiputada de Vox.:
Margarita de la Pisa, eurodiputada de Vox.:  Ion Arocena, director general de la Asociación Española de Bioempresas (Asebio):
Ion Arocena, director general de la Asociación Española de Bioempresas (Asebio):  Javier Padilla, secretario de Estado de Sanidad:
Javier Padilla, secretario de Estado de Sanidad: