La Comisión Europea ha publicado este martes el texto legal con los requerimientos para establecer un sistema eficaz en la lucha contra la falsificación de medicamentos, un reto considerable para autoridades sanitarias de los estados miembro, fabricantes, mayoristas y farmacéuticos. Tienen tres años para cumplirlos.
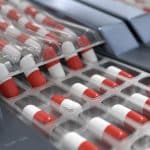
La Agencia Europea de Medicamentos (EMA) ha dado a conocer dos nuevas medidas “en beneficio de la seguridad de los pacientes”: el identificador único (un código de barras bidimensional) y el dispositivo contra la manipulación de los medicamentos, que tendrán que incorporarse a la mayor parte de los medicamentos de uso humano, con contadas excepciones.
La Organización Europea de Verificación de Medicamentos (EMVO) ha reaccionado el mismo martes celebrando la publicación de la normativa como herramienta clave para impedir que los medicamentos falsificados lleguen a la cadena de suministro legal, “tal como manda la Directiva contra Medicamentos Falsificados 2011/62/EC”.
Comprobación sistemática
Los productos medicinales afectados por la directiva tendrán que someterse a verificaciones sistemáticas en el punto de dispensación, además de otras en la cadena de suministro y, adicionalmente, pasar por los controles que establezca una infraestructura europea cuyos brazos se extenderán a los estados.
Según la valoración de la EMVO, la nueva normativa está en sintonía con los principios básicos de la legislación europea en materia de armonización de las exigencias de seguridad y verificación de la autenticidad de los medicamentos, ofreciendo mayor garantía sobre la seguridad de los fármacos con sistemas de verificación que pueden operar en toda la UE en mejores condiciones de coste-efectividad.
Si con el establecimiento de la EMVO, en el cual participaron los actores de la cadena de suministro de medicamentos europeos (EFPIA, EGA, EAEPC, GIRP y PGEU), se hizo un "notable" esfuerzo por mejorar la seguridad del medicamento, ahora son las autoridades nacionales las que tienen que asegurar su interoperabilidad, y tienen hasta principios de 2019 para hacerlo.
Sonia Ruiz Morán, presidenta de EMVO, ha dicho al respecto que “aún queda mucho por hacer, y el plazo de implementación es corto, pero confiamos en que con la claridad de la directiva y el sólido trabajo adelantado en los últimos años, los implicados están en buenas condiciones para establecer la organización europea y el entramado esencial para la provisión de medicamentos seguros a todos los ciudadanos europeos”.


















 Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia:  Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados:
Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados: