La Comisión Interministerial de Precios de los Medicamentos (CIPM) establece de forma ordinaria diversas restricciones al uso de los medicamentos que aprueba. Unas restricciones que son mucho más acusadas en el caso de los medicamentos nuevos o la aprobación de nuevas indicaciones.
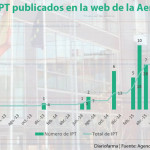
De los 14 medicamentos nuevos o financiación de indicaciones que se han visto en las dos últimas reuniones de la CIPM, que tuvieron lugar el 30 de mayo y el 27 de junio, en nueve ocasiones se han explicitado reservas singulares o condiciones de revisión de precios en función de las ventas u otros parámetros. De este modo, el 64,2% de las aprobaciones de estas dos últimas reuniones de la CIPM han llevado aparejado algún tipo de control, según un análisis realizado por Diariofarma.
Las reservas singulares se refieren principalmente a designación de los medicamentos como de diagnóstico hospitalario (DH) pero se acuerda limitar la dispensación sin necesidad de visado, a los pacientes no hospitalizados en los Servicios de Farmacia de los Hospitales (DHSC). En las dos últimas reuniones de la CIPM se han designado de este modo tres nuevos medicamentos con varias presentaciones, además de algunos genéricos que heredan las condiciones de prescripción y dispensación del fármaco original.
En el apartado de otras condiciones de autorización, la revisión anual de las ventas y los precios fijados es la más habitual y aparece en ocho de los 14 medicamentos nuevos o sus indicaciones aprobados. Los criterios con los que se revisarán las ventas no se reflejan en la información publicada por el Ministerio de Sanidad, sino que quedará recogida en la resolución de financiación. No obstante, hay una excepción en esta última reunión de la CIPM. Se trata de Darzalex de Janssen, para el que se ha establecido un límite de pacientes tratados para la nueva indicación aprobada (combinación con bortezomib, melfalán y prednisona para el tratamiento de pacientes adultos con mieloma múltiple de nuevo diagnóstico que no son candidatos a un trasplante autólogo de progenitores hematopoyéticos). En concreto, para esta indicación, se revisará el precio si se superan los 48 pacientes en tratamiento para dicha indicación el primer año, 85 pacientes el segundo año y 135 pacientes el tercero. De este modo, se establece que las comunidades remitan la información sobre estos tratamientos, con una periodicidad mensual, a la Dirección General de Cartera Básica de Servicios del Sistema Nacional de Salud y Farmacia.
Reunión del 27 de junio
En lo que se refiere a las decisiones tomadas en la reunión de la CIPM del pasado 27 de junio cabe destacar la aprobación de ocho nuevos medicamentos, varios de ellos genéricos. Como nuevo medicamento se ha aprobado Odomzo de Ranbaxy, al que además de remitir al hospital para su dispensación como reserva singular se ha establecido una revisión anual de ventas.
Además, se ha aprobado una nueva presentación de Xeljanz de Pfizer, además de nuevas indicaciones para otra presentación ya autorizada. Para las indicaciones de artritis psoriásica y de colitis ulcerosa, desde la CIPM se han establecido condiciones específicas de utilización en el seno de la prestación farmacéutica del SNS, además de la restricción de su dispensación a los servicios de farmacia hospitalaria sin necesidad de visado.
Otro medicamento que ha ganado indicaciones financiadas por el SNS ha sido Darzalex de Janssen. En concreto se ha financiado combinación con bortezomib, melfalán y prednisona para el tratamiento de pacientes adultos con mieloma múltiple de nuevo diagnóstico que no son candidatos a un trasplante autólogo de progenitores hematopoyéticos. Como se comentaba anteriormente, para este medicamento se ha establecido el número máximo de pacientes a tratar con la nueva indicación aprobada.
Respecto a la información sobre las nuevas indicaciones, cabe destacar que la información ofrecida ahora por Sanidad es mucho más clara ya que especifica de forma aislada cuáles son las indicaciones que se han visto afectadas por el expediente abordado en la CIPM.
En lo que se refiere a aprobaciones de medicamentos en fase de alegaciones, cabe destacar Zejula de Tesaro Bio, que ha logrado el visto bueno de la CIPM a las alegaciones presentadas por el laboratorio. Eso sí, será sometido a reservas singulares de dispensación en hospitales, se restringe la financiación al cumplimiento de una serie de criterios establecidos en el Informe de Posicionamiento Terapéutico y se establece una revisión anual de ventas.
También en lo que se refiere a aprobaciones cabe destacar varios genéricos de como tigeciclina, sitagliptina, prednisolona, dronedarona, alitretionina o silodosina
Por último, la CIPM ha acordado la no no inclusión en la prestación farmacéutica del SNS de Penthrox 99,9% de Mundipharma. La decisión de la CIPM se ha tomado “teniendo en cuenta el valor terapéutico del medicamento y su relación coste-efectividad frente a las otras alternativas existentes”.














 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: