CONSENSO SOBRE LA OSTEOPOROSIS POSTMENOPÁUSICA EN LA CAPV- Enero 2015
Autores:
- Iñigo Aizpurua (CEVIME. Dirección Farmacia).
- Maite Álvarez (Sociedad Vasca de Medicina Interna. Sº Medicina Interna. Hospital Donostia).
- Ainara Echeto (Sº Prestaciones Farmacéuticas. Dirección de Farmacia).
- Iñigo Etxebarria (Sociedad Vasco Navarra de Cirugía Ortopédica y Traumatología. Sº Traumatología. Hospital Alto Deba).
- Julia Fernández (Sociedad Española Farmacéuticos Atención Primaria-Vocalía Euskadi. Servicio de Farmacia. OSI Bilbao-Basurto).
- Mª José Gardeazabal. (Sº Prestaciones Farmacéuticas. Dirección de Farmacia).
- Lola Martínez (Vocalía del País Vasco de la Sociedad Española de Farmacia Hospitalaria. Sº Farmacia. Hospital Universitario de Araba)
- Concha Mendoza (Osatzen-Sociedad Vasca de Medicina de Familia y Comunitaria. Centro de Salud de Aranbizkarra II. Comarca Araba.)
- Ana Ruibal (Sociedad Reumatológica de Euskadi. Sº Reumatología. Hospital Universitario de Araba).
- Marta Quintana (Sociedad Vasca de Ginecología y Obstetricia. Sº Ginecología. Hospital Universitario de Araba).
- Ricardo Samper (Farmacia. Osakidetza – Dirección de Asistencia Sanitaria)
- Iñaki Torre (Consulta de Enfermedades Óseas Metabólicas del Sº de Reumatología. Hospital Basurto).
- 1. INTRODUCCIÓN
La osteoporosis, factor de riesgo para sufrir fracturas por fragilidad, representa un problema de salud pública debido a su alta prevalencia y a las repercusiones sociosanitarias y económicas que supone. Debido al incremento de la esperanza de vida y el consiguiente envejecimiento de la población, se prevé que su prevalencia irá en aumento en los próximos años.
Existe una gran variabilidad en las diferentes guías que asesoran sobre su manejo, y es bien conocido que su tratamiento farmacológico es en muchas ocasiones incorrecto, bien por defecto, dejando de tratar a mujeres con alto riesgo de fractura que se beneficiarían del mismo sobre todo en prevención secundaria, como por exceso, principalmente en prevención primaria, medicalizando a mujeres con bajo riesgo de fractura, sin claro beneficio y exponiéndolas a efectos secundarios potencialmente graves.
La elaboración de este consenso obedece a la necesidad sentida de disponer de un documento que ayude a los profesionales sanitarios a un mejor manejo de esta patología.
Impulsado por la Dirección de Farmacia del Departamento de Salud del Gobierno Vasco, en él han participado miembros de las Sociedades Científicas más implicadas en el tema (reumatología, medicina de familia, traumatología, ginecología, medicina interna, farmacia hospitalaria y farmacia de atención primaria), junto con farmacéuticos del Departamento de Salud y de la Dirección General de Osakidetza-Servicio Vasco de Salud.
- 2. ¿CUANDO HAY QUE SOLICITAR UNA DENSITOMETRÍA?
Consideraciones generales
• El cribado densitométrico no es coste-efectivo y la indicación de realizar una densitometría debe basarse en criterios clínicos que nos permitan seleccionar a las pacientes en las cuales su utilización resulte eficiente.
• El manejo clínico de las pacientes debe ser individualizado, sin que unas determinadas recomendaciones protocolizadas de solicitud de prueba excesivamente rígidas lo impidan.
• Como técnica de referencia para medir la Densidad Mineral Ósea (DMO), se recomienda la absorciometría radiográfica de doble energía (dual energy x-ray absorptiometry [DXA]) en cadera y columna vertebral.
• La solicitud de la prueba debe ser realizada para condicionar una actitud terapéutica.
Criterios para solicitar una densitometría
Las recomendaciones de las diferentes guías para el abordaje de la valoración del riesgo de fractura mediante DXA muestran una importante variabilidad1. Aunque la mayoría de los documentos recomiendan la realización de densitometría ósea en la población con algún factor de riesgo, el tipo y número de factores considerados y los grupos de edad sobre los que operan son diferentes2-8. Nuestra recomendación es:
- 1. Pacientes con fractura previa por fragilidad (vértebra, cadera, muñeca o tercio proximal de húmero). En el caso de las fracturas de vértebra y cadera, aunque no es necesaria la realización de DXA para iniciar el tratamiento, sí se considera aconsejable realizarla para evaluar la eficacia del mismo.
- 2. Presencia de dos factores de riesgo mayore
- 3. Presencia de un factor de riesgo mayor más dos factores de riesgo menor
FACTORES DE RIESGO MAYORES
- Edad ≥ 65 años
- Tratamiento con prednisona a dosis ≥ 7,5mg/día durante más de 3 meses.
- Antecedente familiar de fractura de cadera
- IMC < 20 Kg/m2
- Menopausia precoz < 45 años (no tratada)
- Caídas (>2 caídas en el último año)
FACTORES DE RIESGO MENORES
- Tabaquismo activo
- Alcohol: > 20 U/semana en hombre y > 13U/semana en mujer
- Enfermedades crónicas osteopenizantes: artritis reumatoide, enfermedades digestivas que condicionen malabsorción, diabetes mellitus tipo 1, hiperparatiroidismo
- Tratamiento con fármacos osteopenizantes: inhibidores de la aromatasa, anticonvulsivantes, citostáticos, heparina, antirretrovirales
Densitometrías de seguimiento
• Todas las guías recomiendan realizar DXA para monitorizar la respuesta al tratamiento1,9, y aunque existe variabilidad respecto a la periodicidad de las densitometrías de seguimiento, la mayoría de ellas proponen su realización después de 2 años del inicio de la terapia y posteriormente, si la DMO permanece estable, con menor frecuencia9.
• En pacientes que no reciben tratamiento, para determinar la periodicidad de las densitometrías de seguimiento, el determinante principal es el valor basal de T-score, junto con la valoración de los factores de riesgo de fractura. Así, en pacientes con DMO baja (T-score -2 a -2,49) o con factores de riesgo de pérdida de masa ósea (p. ej. uso de corticoides, hiperparatiroidismo) se recomienda repetir DXA cada 2 años. Si la DMO está en valores de T-score entre -1,5 a -1,99 y no hay factores de riesgo de pérdida de masa ósea, la DXA se recomienda cada 3-5 años. En pacientes con DMO normal o ligeramente baja (T-score -1,01 a -1,49) y sin factores de riesgo de pérdida de masa ósea, se recomienda cada 10-15 años10.
- 3. ¿A QUIÉN HABRÍA QUE INSTAURAR UN TRATAMIENTO FARMACOLÓGICO?
Los fármacos antiosteoporóticos deben indicarse a pacientes con un riesgo elevado de fractura para reducirlo. El problema es identificar de forma adecuada quién tiene riesgo alto de fractura, ponderando sus factores de riesgo mayores y/o menores. El mayor riesgo lo presentan aquellas pacientes con antecedentes previos de fracturas por fragilidad, aunque éstas no hayan tenido una expresión clínica evidente (fracturas vertebrales detectadas por morfometría)11.
La combinación de los factores de riesgo clínicos de fractura por fragilidad con la medida de la DMO (DXA central) es el método más eficaz para la valoración del riesgo de fractura 12. Para ello disponemos de múltiples escalas de predicción de riesgo de fractura. De entre todas ellas, la herramienta más usada actualmente es el FRAX, que además se puede seleccionar para población española. El problema es que a día de hoy no hay un umbral ni diagnóstico, ni terapéutico definido en nuestra población (porque no está determinado el umbral de coste- efectividad), aunque en este momento está en proceso de validación.
Asimismo, también se ha constatado que el mayor beneficio de los tratamientos que han mostrado ser eficaces se obtiene en las mujeres > 65 años, quienes presentan, a su vez, un mayor riesgo de fractura13.
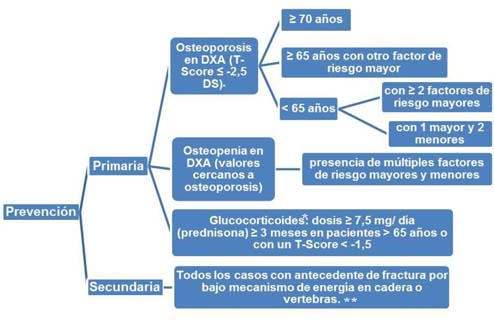
Podemos dividir la prevención de fracturas en primaria (sin antecedente de fracturas previas por bajo mecanismo de energía, BME) y secundaria (antecedente de fracturas por BME), siendo de este grupo las más importantes las de cadera y las vertebrales.
A la hora de establecer recomendaciones en la instauración de tratamiento, es de destacar la variabilidad en este aspecto que presentan las guías dedicadas a asesorar en el manejo de esta enfermedad1.
Se revisan las principales guías y documentos clínicos de tratamiento tanto nacionales (SEMERGEN 200614, semFYC 201415, SEIOMM 20085, SECOT 201016, Guía salud-SNC 201012 y SER 201117) como internacionales (NOGG 20146, NOF 20133, AACE 201018, NAMS 201019, Osteoporosis Canadá 201020, NICE 201121,22) en la prevención primaria y secundaria de la fractura osteoporótica.
Teniendo en cuenta todo lo anterior, la recomendación para instaurar tratamiento farmacológico sería la recogida en el siguiente algoritmo:
*El tratamiento con medicamentos para la osteoporosis se debe instaurar tan pronto como se inicien los glucocorticoides a dosis > 7,5 mg/día y si se prevé que este tratamiento se prolongue al menos 3 meses. Mantener el tratamiento únicamente mientras se mantengan las dosis > 7,5 mg/día de glucocorticoides5,23.
**Con la evidencia científica actual la fractura de muñeca y de tercio proximal de húmero por bajo mecanismo de energía no se considera indicación de prevención secundaria, si no coexisten otros factores de riesgo, pero deberían considerarse como factor de riesgo mayor al plantear la necesidad de tratamiento.
- 4. ¿CÓMO TRATAR LA OSTEOPOROSIS POSTMENOPÁUSICA?
4.1. INTRODUCCIÓN
El objetivo de tratar la osteoporosis es evitar las fracturas. Las fracturas de cadera suponen una gran pérdida de calidad de vida para las personas que las sufren. De hecho, 1 de cada 5 personas que ha sufrido una fractura de cadera no vive más de un año tras la fractura y únicamente 1/3 de los pacientes que han sufrido una fractura de cadera recupera el estado de salud previo a la misma24. Por ello es importante conocer qué tratamientos han demostrado prevenir las fracturas de cadera en los ensayos clínicos. Las fracturas vertebrales pueden producir dolor, dificultades para respirar, problemas gastrointestinales, y dificultades para realizar las actividades diarias. Aunque la mayoría de ellas no son detectadas clínicamente, se asocian también con aumento de la mortalidad21. Otro aspecto a tener en cuenta es que la mayoría de los ensayos se han realizado en poblaciones con una media de edad de 70 años o más y en mujeres con osteoporosis densitométrica y fractura vertebral previa, factor a tener en cuenta en cuanto a qué población se beneficiará del tratamiento.
4.2. MEDIDAS NO FARMACOLÓGICAS
INGESTA ADECUADA DE CALCIO Y VITAMINA D
El primer paso en la prevención y tratamiento de la osteoporosis es una adecuada ingesta de calcio y vitamina D25. La ingesta adecuada se debe conseguir principalmente a través de la dieta. Para conocer la ingesta de calcio en la dieta, puede ser de ayuda consultar la base de datos española de composición de alimentos, desarrollada y actualizada por la Redbedca (http://www.bedca.net/).
EJERCICIO FÍSICO
Se recomienda realizar ejercicio físico al menos 30 minutos tres veces a la semana. Existe evidencia de la eficacia del ejercicio físico en la reducción del riesgo de fracturas en población de edad avanzada, y de fracturas de cadera en mujeres ancianas. El ejercicio también tiene un efecto beneficioso, aunque débil, sobre la densidad mineral ósea. No existe evidencia de que el ejercicio de alta intensidad (correr) sea más beneficioso que el de baja intensidad (caminar). Es importante que el ejercicio sea agradable para asegurarnos el cumplimiento a largo plazo9.
DESHABITUACIÓN TABÁQUICA
Se debe aconsejar firmemente el abandono del tabaco, ya que éste acelera la pérdida de hueso, además de otros efectos perjudiciales para la salud, ya conocidos9.
ALCOHOL
El consumo de 3 o más unidades de alcohol al día es perjudicial para la salud del hueso y aumenta el riesgo de caídas23.
PREVENCIÓN DE CAÍDAS26-27
Las caídas son el principal factor de riesgo de fractura, por lo que su prevención es el tratamiento de primera línea, antes que los fármacos, para las mujeres con alto riesgo de fracturas. Se estima que el 90% de las fracturas de fémur se deben a caídas. Existen estudios que demuestran que las estrategias multifactoriales para disminuir el riesgo de caídas (adecuado aporte nutricional, ejercicio físico y evaluación de los factores de riesgo), son efectivas en población anciana.
Otras medidas a tener en cuenta para prevenir las caídas:
Mejorar visión y equilibrio
Retirar medicamentos que causen sedación
Retirar alfombras, adecuar baños, buena iluminación…
Cuidado con los animales domésticos
4.3. TRATAMIENTO FARMACOLÓGICO
SUPLEMENTOS DE CALCIO Y VITAMINA D
Los suplementos de calcio y vitamina D han mostrado eficacia en mujeres de edad avanzada institucionalizadas con una baja ingesta dietética de calcio, reduciendo significativamente el riesgo de fracturas de cadera y no vertebrales28.
Prácticamente todos los ensayos clínicos con fármacos para la osteoporosis han incluido de forma rutinaria la administración conjunta de suplementos de calcio y vitamina D. Por ello las guías de osteoporosis recomiendan su uso conjunto y las fichas técnicas de los mismos recogen que si el aporte de calcio con la dieta es inadecuado, los pacientes deben recibir aporte complementario de calcio y vitamina D28.
Las cantidades diarias recomendadas en mujeres postmenopáusicas con osteoporosis son de 1000-1200 mg/día de calcio y 800 UI/día de vitamina D3,12,23,25. Ante la duda de administrar vitamina D, algunos clínicos recomiendan realizar determinación de 25-hidroxi-vitamina D y administrarla solo en caso de deficiencia29.
Existe controversia acerca del posible aumento del riesgo cardiovascular asociado a los suplementos de calcio, particularmente si se excede la dosis diaria recomendada o se administran suplementos a dosis altas. Hasta que no se aclare este aspecto, puede ser prudente intentar que el aporte proceda en su mayor parte de la dieta, y en caso de usar suplementos de calcio, evitar dosis superiores a 500 mg en cada administración23,24,25,28,30.
BISFOSFONATOS
Son considerados los tratamientos de elección en la osteoporosis postmenopáusica. Actúan inhibiendo la resorción ósea. Alendronato31-33, risedronato34-36 y ácido zoledrónico37 han demostrado prevenir las fracturas vertebrales, no vertebrales y fracturas de cadera en mujeres postmenopáusicas con osteoporosis establecida. No existen estudios comparativos en la prevención de fracturas entre estos bisfosfonatos.
Alendronato es el recomendado en varias guías por ser el más coste-efectivo12,21,22. El ácido zoledrónico podría ser una alternativa para aquellas pacientes con problemas de adherencia al tratamiento. Ibandronato, a pesar de ser un bisfosfonato ampliamente utilizado en nuestro medio por administrarse una vez al mes, únicamente ha demostrado reducir las fracturas vertebrales y no ha demostrado reducir las no vertebrales ni las de cadera38.
Respecto a los efectos adversos de los bisfosfonatos, los más preocupantes por su gravedad, aunque se dan con una frecuencia muy baja, son el incremento del riesgo de fracturas atípicas de fémur y la osteonecrosis mandibular asociados a su uso a largo plazo.
DENOSUMAB
Anticuerpo monoclonal que impide la activación de los osteoclastos inhibiendo también la resorción ósea. Ha demostrado prevenir las fracturas vertebrales, no vertebrales y fracturas de cadera en mujeres postmenopáusicas39. No existen ensayos comparativos frente a bisfosfonatos en la prevención de fracturas.
Su perfil de seguridad no es del todo conocido. Se han descrito casos aislados de osteonecrosis mandibular. En septiembre de 2014 se ha publicado una nota de seguridad de la AEMPS advirtiendo de los riesgos de osteonecrosis mandibular e hipocalcemia observados con este fármaco, y estableciendo la necesidad de ciertas medidas preventivas y la monitorización de la calcemia40.
Denosumab se administra una vez cada 6 meses por vía subcutánea, lo que supone una mayor comodidad para el paciente y favorece el cumplimiento. Se considera un medicamento de segunda elección debido a que su perfil de seguridad a largo plazo es menos conocido (datos publicados de estudios a 6 años)41 y su coste más elevado.
MODULADORES SELECTIVOS DEL RECEPTOR DE ESTRÓGENOS (SERM).
Actúan como agonistas y/o antagonistas del receptor estrogénico, dependiendo del tipo de célula y tejido y de los genes diana. En el hueso, disminuyen la resorción ósea.
Raloxifeno ha demostrado disminuir la pérdida de DMO y reducir el riesgo de fracturas vertebrales en mujeres con osteoporosis posmenopáusica, pero no reduce el riesgo de fracturas no vertebrales42,43. El El incremento de eventos tromboembólicos es su principal efecto adverso44,45.
Bazedoxifeno ha demostrado acción protectora en la pérdida de DMO y en la reducción de fracturas vertebrales en mujeres con osteoporosis posmenopáusica, pero no ha demostrado eficacia en la reducción de fracturas no vertebrales, excepto en población con alto riesgo de fracturas (análisis post hoc) 46-48. Aunque su perfil de seguridad a corto plazo parece similar al de raloxifeno, a largo plazo la información es más limitada45.
Los SERM se recomiendan como tercera línea de tratamiento si no se toleran los bisfosfonatos ni denosumab. Podrían estar indicados en mujeres con alto riesgo de fractura y con riesgo de cáncer de mama receptor estrogénico positivo. Se recomienda utilizar raloxifeno frente a bazedoxifeno, por disponer de más datos de seguridad a largo plazo y por su menor coste.
TERIPARATIDA (PTH 1-34)
Teriparatida (PTH 1-34) actúa estimulando la formación de hueso, aumentando la absorción intestinal y la reabsorción tubular de calcio y la excreción de fosfatos por el riñón49. La hormona paratiroidea (PTH1-84) no está disponible en el mercado español desde el año 2013.
La teriparatida ha demostrado eficacia en la reducción de fracturas vertebrales y no vertebrales en mujeres postmenopáusicas con osteoporosis; sin embargo, no ha demostrado este efecto en las fracturas de cadera50.
Los estudios preclínicos en ratas indican una mayor incidencia de osteosarcoma con la administración de teriparatida a largo plazo. Aunque no hay una relación causal claramente establecida y no se han observado casos de osteosarcoma en humanos, la duración máxima del tratamiento es de dos años. La Ficha Técnica de teriparatida establece además que el ciclo de 24 meses de tratamiento no debe repetirse a lo largo de la vida del paciente51.
Sus principales efectos adversos son: hipercalcemia, náuseas y cefalea49.
No se considera un fármaco de primera línea, dado que al contrario que bisfosfonatos y denosumab, no ha demostrado eficacia en la reducción de fracturas de cadera y faltan datos sobre su seguridad a largo plazo, por lo que el tratamiento no se puede prolongar más de dos años. Otros inconvenientes son la vía de administración subcutánea, la necesidad de conservación en frigorífico y su elevado coste9,23,49.
Teriparatida podría reservarse para mujeres postmenopáusicas con osteoporosis severa (T- score< -2,5) y al menos una fractura por fragilidad en las que otros tratamientos no se hayan tolerado o hayan resultado ineficaces (aparición de fracturas a pesar del tratamiento)9,49.
RANELATO DE ESTRONCIO
Ranelato de estroncio actúa aumentando la acción de los osteoblastos y disminuyendo la resorción ósea. Ha demostrado prevenir las fracturas vertebrales52 y no vertebrales53,pero no las de cadera en mujeres con osteoporosis posmenopáusica.
La evaluación periódica de los datos de seguridad por parte del Comité Europeo para la Evaluación de Riesgos en Farmacovigilancia ha dado lugar a numerosas alertas de seguridad en los últimos años relacionadas con los aumentos de riesgo de reacciones cutáneas graves54, tromboembolismo venoso55 e infarto de miocardio56, aparte de otros riesgos ya descritos de alteraciones de la conciencia, convulsiones, hepatitis y citopenias57. En agosto de 2014 se califica a ranelato de estroncio como medicamento de diagnóstico hospitalario, por lo que requiere visado previo a su dispensación dentro del Sistema Nacional de Salud58.
Considerados estos riesgos en el contexto de su eficacia limitada en la prevención de fracturas graves, la revisión de su balance beneficio-riesgo concluye que su uso debe restringirse a pacientes con osteoporosis severa y alto riesgo de fracturas que no puedan utilizar ninguna otra alternativa terapéutica y no presentan ni tienen antecedentes de cardiopatía isquémica, enfermedad arterial periférica o patología cerebrovascular. No debe utilizarse en pacientes con hipertensión arterial no controlada57,58.
Se debe valorar el riesgo cardiovascular de la paciente antes del inicio del tratamiento y periódicamente durante el mismo.
RESUMEN DE RECOMENDACIONES DE TRATAMIENTO
- Los bisfosfonatos se consideran el tratamiento de elección en mujeres con osteoporosis postmenopáusica. Alendronato es el más coste-efectivo. No se recomienda utilizar ibandronato porque no ha demostrado reducir las fracturas no vertebrales ni de cadera.
- Denosumab es el tratamiento de 2ª elección, cuando los bisfosfonatos estén contraindicados o no se toleren, debido a su perfil de seguridad menos conocido y a su coste más elevado.
- Los SERM serían la 3ª línea de tratamiento cuando bisfosfonatos o denosumab estén contraindicados o no se toleren. Raloxifeno sería el de elección por disponer de más datos de seguridad a largo plazo y ser más coste-efectivo.
- Teriparatida podría reservarse para mujeres postmenopáusicas con osteoporosis severa (T-score< -2,5) y al menos una fractura por fragilidad en las que otros tratamientos no se hayan tolerado o hayan resultado ineficaces (aparición de fracturas a pesar del tratamiento).
- 5. VACACIONES TERAPÉUTICAS CON BISFOSFONATOS
Los bisfosfonatos por sus características farmacocinéticas, se acumulan en el hueso, ejerciendo un efecto protector que puede persistir después de suspender el tratamiento. La evidencia de este efecto protector, junto con la preocupación por los efectos adversos asociados a su uso prolongado, hace que en las pacientes de bajo riesgo de fractura sea razonable considerar un descanso en el tratamiento, también denominado “vacaciones terapéuticas59-67.
Existen dos ensayos clínicos que compararon los efectos de alargar el tratamiento con bisfosfonatos frente a suspenderlo transcurrido un tiempo (3-5 años):
o En el estudio FLEX63 se comparó el tratamiento con alendronato durante 5 o 10 años en mujeres postmenopáusicas con osteoporosis. No se observaron diferencias significativas en la incidencia de nuevas fracturas (ni vertebrales morfométricas ni no vertebrales). Sin embargo sí hubo diferencias en las fracturas vertebrales clínicas.
o En el estudio HORIZON64, se comparó el tratamiento con ácido zoledrónico
durante 3 o 6 años en mujeres postmenopáusicas con osteoporosis. No se observaron diferencias significativas en la incidencia de las fracturas vertebrales clínicas ni no vertebrales, aunque sí hubo diferencias en las fracturas vertebrales morfométricas.
También se realizó un estudio observacional de extensión del ensayo VERT con risedronato. En este estudio, las mujeres que habían recibido risedronato o placebo durante 3 años fueron reevaluadas al año de finalizar la terapia. La incidencia de nuevas fracturas vertebrales en las mujeres previamente tratadas con risedronato continuó siendo menor (6,5% vs 11,6%)65.
Teniendo en cuenta lo anterior, en el caso de utilizar alendronato o risedronato, es razonable retirarlos al cabo de 5 años de tratamiento en mujeres que no tengan riesgo elevado de fractura; en pacientes de alto riesgo, los datos sugieren continuar con la terapia 59-63,65-66. En el caso de utilizar ácido zoledrónico, es razonable retirarlo al cabo de 3 años de tratamiento en mujeres que no sean de alto riesgo de fractura; en pacientes de alto riesgo, valorar su continuación6,64,67 (ver cuadro de recomendaciones).
En cuanto a la duración de las vacaciones terapéuticas, no hay estudios clínicos adecuados que hayan delimitado cuanto tiempo se mantienen los beneficios del tratamiento después de la interrupción. Se necesitan más datos para determinar si los marcadores de recambio óseo o la densidad mineral ósea pueden ayudar de forma fiable en las decisiones relativas a la duración e interrupción del tratamiento con bisfosfonatos60,61, aunque en la práctica clínica se plantean actualmente como los únicos medios para tener una idea de la pérdida de efecto del tratamiento en la remodelación ósea66. Los factores clínicos de riesgo de fracturas y las preferencias de la paciente también se deberían tener en cuenta a la hora de tomar esta decisión60,68.
RECOMENDACIONES PARA LA EVALUACIÓN DE LA CONTINUACIÓN DEL TRATAMIENTO CON BISFOSFONATOS TRAS 5 AÑOS (3 AÑOS EN EL CASO DE ÁCIDO ZOLEDRÓNICO) (Adaptado de referencia 67)
| Riesgo de fractura | Acción a tomar / Duración
del tratamiento |
Recomedaciones /
Duración del descanso |
| Riesgo bajo
- < 70 años - Sin fractura previa - IMC > 20 - Sin antecedente familiar de fractura de cadera - Sin tratamiento con corticoides durante más de 3 meses ó inhibidores de la aromatasa |
Suspender bisfosfonato | Revisar factores de riesgo a partir de los 70 años (cada 3- 5 años) |
| Riesgo moderado
- > 70 años - y antecedente familiar de fractura - y/o IMC < 20 |
Suspender bisfosfonato | Valorar descanso 3-5 años (ó menos si pérdida significativa DMO** o fractura). Revisar factores de riesgo cada 2 años |
| Riesgo alto
- Fractura previa y/o - Tratamiento corticoideo durante más de 3 meses o inhibidores de la aromatasa |
Mantener el tratamiento durante 10 años.
Educar al paciente para evitar caídas |
Pasados los 10 años, valorar descanso 1-2 años (ó menos si pérdida significativa DMO ó fractura). Podría reiniciarse nuevamente el bisfosfonato pasado este tiempo.
Valorar tratamiento alternativo durante el descanso con bisfosfonatos* |
* Individualizar el tratamiento; no hay evidencia científica más allá de los 10 años de tratamiento con bisfosfonatos, ni tampoco acerca del tratamiento alternativo más adecuado. Si se mantiene un riesgo alto de fractura, una alternativa podría ser cambiar a un fármaco con diferente mecanismo de acción (por ejemplo, Teriparatida).
** Pérdida significativa DMO: pérdida 5% de la DMO en al menos 2 mediciones por DXA, realizadas por lo menos con 2 años de diferencia68.
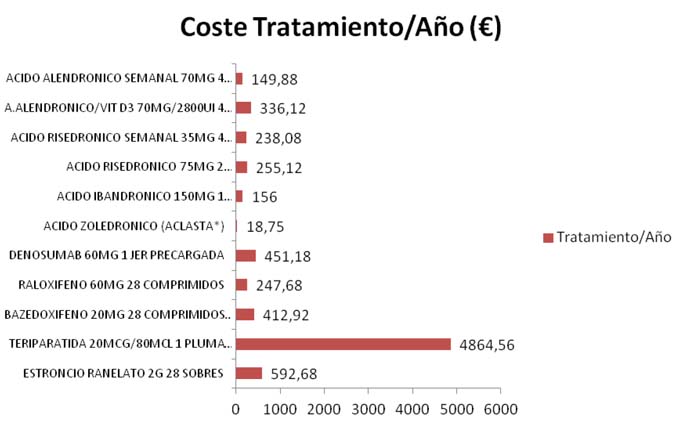
- 6. COSTE-TRATAMIENTO/AÑO DE CADA UNA DE LAS ALTERNATIVAS
Los cálculos corresponden a los precios PVP IVA (€) del mes de diciembre (2014). *PVL/uso hospitalario.
BIBLIOGRAFÍA.
- Sanfélix-Genovés J, Catalá-López F, Sanfélix-Gimeno G, Hurtado I, Baixauli C, Peiró S. Variabilidad en las recomendaciones para el abordaje clínico de la osteoporosis. Med Clin (Barc). 2014;142(1):15-22.
- International Society for Clinical Densitometry. 2013 ISCD Official Positions-Adult. Disponible en: www.iscd.org/official-positions/2013-iscd-official-positions-adult.
- National Osteoporosis Foundation. Clinician’s Guide to Prevention and Treatment of Osteoporosis. Washington, DC: National Osteoporosis Foundation; 2013. Disponible en: http://nof.org/files/nof/public/content/file/917/upload/481.pdf.
- Kanis JA, Borgstrom F, De Laet C, Johansson H, Johnell O, Jonsson B et al. Assessment of fracture risk. Osteoporos Int. 2005;16:581-589.
- González-Macías J, Guañabens G, Gómez Alonso C, Del Río Barquero L, Muñoz Torres M, Delgado M el al. (en representación del Comité de Expertos de la SEIOMM para la elaboración de las Guías). Guías de práctica clínica en la osteoporosis postmenopáusica, glucocorticoidea y del varón. Sociedad Española de Investigación Ósea y del Metabolismo Mineral. Rev Clin Esp. 2008;208(Supl 1):1-24.
- Compston JE, Cooper AL, Cooper C, Francis R, Kanis JA, Marsh D, et al. Osteoporosis. Clinical Guideline for prevention and treatment. Executive Summary. Updated November 2014. National Osteoporosis Guideline Group (NOGG). http://www.shef.ac.uk/NOGG/NOGG_Executive_Summary.pdf.
- Roig D, Valero C, Romera M, Rozadilla A, Mateo L, Juanola X, et al. Prevalencia de los criterios de indicación de densitometría ósea y de los factores de riesgo de baja masa ósea y fractura en unidades extrahospitalarias de reumatología. Reumatol Clin.2005;1(1):12-9.
- De la Higuera López-Frías M, Fernández García D, Muñoz-Torres M. Densitometría ósea: usos clínicos y evidencia científica. Rev Clin Esp. 2004;204(9):480-2.
- Rosen HN, Drezner MK. Overview of the management of osteoporosis in postmenopausal women. ©2014UpToDate, Inc.
- Kleerekoper M. Screening for osteoporosis. ©2014UpToDate, Inc.
- Muñoz-Torres M, Jódar Gimeno E. Osteoporosis: informe del Grupo de Trabajo de Metabolismo Mineral Óseo de la SEEN. Endocrinol Nutr. 2007;54(1):53-61.
- Grupo de trabajo de la Guía de Práctica Clínica sobre Osteoporosis y Prevención de Fracturas por Fragilidad. Guía de Práctica Clínica sobre Osteoporosis y Prevención de Fracturas por Fragilidad. Plan de Calidad para el Sistema Nacional de Salud del Ministerio de Sanidad, Política Social e Igualdad. Agència d´Informació, Avaluació i Qualitat en Salut (AIAQS) de Cataluña;2010.Guías de Práctica Clínica en el SNS:AATRM Nº 2007/02.
- Grupo de trabajo de menopausia y postmenopausia. Guía de práctica clínica sobre la menopausia y postmenopausia. Barcelona: Sociedad Española de Ginecología y Obstetricia, Asociación Española para el Estudio de la Menopausia, Sociedad Española de Medicina de Familia y Comunitaria y Centro Cochrane Iberoamericano; 2004. Disponible en: http://www.infodoctor.org/rafabravo/guiamenopausia.pdf
- Documentos Clínicos SEMERGEN. Osteoporosis. Madrid: Sociedad Española de Médicos de Atención Primaria; 2006. Disponible en: http://www.semergen.es/semergen/sites/default/files/publicaciones/osteoporosis.pdf
- Grupo de Trabajo de Enfermedades Reumatológicas de la semFYC. Osteoporosis. Manejo, prevención, diagnóstico y tratamiento. Barcelona: semFYC;2014.
- Guía de práctica clínica sobre osteoporosis. Madrid: Grupo de Estudio e Investigación de la Osteoporosis, Sociedad Española de Cirugía Ortopédica y Traumatología (SECOT); 2010.
- Pérez Edo L, Alonso Ruiz A, Roig Vilaseca D, García Vadillo A, Guañabens Gay N, Peris P, et al. Actualización 2011 del consenso Sociedad Española de Reumatología de osteoporosis. Reumatol Clin. 2011;7:357–79.
- Watts NB, Bilezikian JP, Camacho PM, Greenspan SL, Harris ST, Hodgson SF, et al. American Association of Clinical Endocrinologists Medical Guidelines for Clinical Practice for the diagnosis and treatment of postmenopausal osteoporosis. Endocr Pract. 2010;16 (Suppl 3):1–37.
- Management of osteoporosis in postmenopausal women: 2010 position statement of The North American Menopause Society. Menopause. 2010;17:25–54.
- Papaioannou A, Morin S, Cheung AM, Atkinson S, Brown JP, Feldman S, et al. 2010 clinical practice guidelines for the diagnosis and management of osteoporosis in Canada: summary. CMAJ. 2010;182(17):1864–73.
- National Institute for Health and Clinical Excellence (NICE). Alendronate, etidronate, risedronate, raloxifene and strontium ranelate for the primary prevention of osteoporotic fragility fractures in postmenopausal women (amended). En: NICE technology appraisal guidance 160. London: National Institute for Health and Clinical Excellence; 2011.
- National Institute for Health and Clinical Excellence (NICE). Alendronate, etidronate, risedronate, raloxifene, strontium ranelate and teriparatide for the secondary prevention of osteoporotic fragility fractures in postmenopausal women (amended). En: NICE technology appraisal guidance 161. London: National Institute for Health and Clinical Excellence; 2011
- BC Guidelines.ca. Osteoporosis: diagnosis, treatment and fracture prevention. October 2012. Disponible en: http://www.bcguidelines.ca/pdf/osteoporosis.pdf
- NIH Consensus Development Panel on Osteoporosis Prevention, Diagnosis and Therapy. Osteoporosis Prevention, Diagnosis and Therapy. JAMA. 2001;285:785-95.
- Rosen HN. Calcium and vitamin D supplementation in osteoporosis. ©2014UpToDate, Inc.
- Cameron ID, Murray GR, Gillespie LD, Robertson MC, Hill KD, Cumming RG, et al. Interventions for preventing falls in older people in nursing care facilities and hospitals. Cochrane Database of Systematic Reviews 2010, Issue 1. Art. No.: CD005465.DOI: 10.1002/14651858.CD005465.pub2.
- Gobierno Hernández J, Pérez de las Casas MO, Madan Pérez MT, Baute Díaz D, Manzaneque Lara C, Domínguez Coello S. ¿Podemos desde atención primaria prevenir las caídas en las personas mayores?. Aten Primaria. 2010;42(5):284-291.
- Suplementos de calcio, osteoporosis y riesgo cardiovascular. INFAC. 2013;21(4):26-31.
- Vitamin D test. Fact Sheet. NPS Medicinewise. November 2014. Disponible en: http://www.nps.org.au/data/assets/pdf_file/0020/265322/Fact-sheet-vitamin-D-tests.pdf
- Vitamina D: evidencias y controversias. INFAC.2012;20(2):7-12.
- Liberman UA, Weiss SR, Bröll J, Minne HW, Quan H, Bell NH et al. Effect of oral alendronate on bone mineral density and the incidence of fractures in postmenopausal osteoporosis. N Engl J Med. 1995;333:1437-43.
- Black DM, Cummings SR, Karpf DB, Cauley JA, Thompson DE, Nevitt MC et al. Randomised Trial of effect of alendronate on risk of fracture in women with existing vertebral fractures. Lancet. 1996; 348: 1535-41.
- Cummings SR, Black DM, Thompson DE, Applegate WB, Barrett-Connor E, Musliner TA et al. Effect of alendronate on risk of fracture in women with low bone density but without vertebral fractures. Results from the Fracture Intervention Trial. JAMA. 1998;280:2077-82.
- Reginster JY, Minne HW, Sorensen OH, Hooper M, Roux C, Brandi ML et al. Vertebral Efficacy with Risedronate Therapy (VERT) Study Group. Randomized trial of the effects of risedronate on vertebral fractures in women with established postmenopausal osteoporosis. Osteoporos Int. 2000; 11:83-91.
- Harris ST, Watts NB, Genant HK, McKeever CD, Hangartner T, Keller M et al. Effects of risedronate treatment on vertebral and nonvertebral fractures in women with postmenopausal osteoporosis. A randomized controlled trial. JAMA. 1999;282: 1344-1352.
- McClung MR, Geusens P, Miller PD, Zippel H, Bensen WG, Roux C et al. Effect of risedronate on the risk of hip fracture in elderly women. N Engl J Med. 2001; 344: 333-40.
- Black DM, Delmas PD, Eastell R, Reid IR, Boonen S, Cauley JA, et al. Once-Yearly Zoledronic Acid for Treatment of Postmenopausal Osteoporosis. N Engl J Med. 2007; 356(18):1809-22.
- Chesnut CH, Skag A, Christiansen C, Recker R, Stakkestad JA, Hoiseth A, et al. Effects of oral ibandronate administered daily or intermittently on fracture risk in postmenopausal osteoporosis. J Bone Miner Res.2004;19(8):1241-9.
- Cummings SR, San Martin J, McClung MR, Siris ES, Eastell R, Reid IR, et al. Denosumab for prevention of fractures in postmenopausal women with osteoporosis. N Engl J Med. 2009;361(8):756-65.
- Nota AEMPS 13/2014.Denosumab (PROLIA®, XGEVA®): riesgo de osteonecrosis mandibular e hipocalcemia.http://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHuman o/seguridad/2014/docs/NI-MUH_FV_13-2014-Denosumab.pdf.
- Bone HG, Chapurlat R, Brandi ML, Brown JP, Czerwinski E, Krieg MA, et al. The effect of three or six years of denosumab exposure in women with postmenopausal osteoporosis: results from the FREEDOM extension. J Clin Endocrinol Metab. 2013;98(11):4483-92.
- Ettinger B, Black DM, Mitlak BH, Knickerbocker RK, Nickelsen T, Genant HK et al. Reduction of vertebral fracture risk in postmenopausal women with osteoporosis treated with raloxifene. Results from a 3-year randomized clinical trial. JAMA.1999;282(7):637-645.
- Delmas PD, Ensrud KE, Adachi JD, Harper KD, Sarkar S, Gennari C, et al. Efficacy of raloxifene on vertebral fracture risk reduction in postmenopausal women with osteoporosis: four-year results from a randomized clinical trial. J Clin Endocrinol Metab. 2002; 87(8):3609-3617.
- Adomaityte J, Farooq M, Qayyum R. Effect of raloxifene therapy on venous thromboembolism in postmenopausal women. A meta-analysis. Thromb Haemost. 2008;99(2):249-455.
- Rosen HN. Selective estrogen receptor modulators for prevention and treatment of osteoporosis. ©2014UpToDate, Inc.
- Silverman SL, Christiansen C, Genant HK, Vukicevic S, Zanchetta JR, de Villiers TJ, et al. Efficacy of bazedoxifene in reducing new vertebral fracture risk in postmenopausal women with osteoporosis: results from a 3 year, randomized, placebo, and active controlled clinical trial. J Bone Miner Res.2008; 23(12):1923-1934.
- Silverman SL, Chines AA, Kendler DL, Kung AWC, Teglbjaerg CS, Felsenberg D, et al. Sustained efficacy and safety of bazedoxifene in preventing fractures in postmenopausal women with osteoporosis: results of a 5-year, randomized, placebo-controlled study. Osteoporos Int. 2012;23(1):351-363.
- Miller PD, Chines AA, Christiansen C, Hoeck HC, Kendler DL, Lewiecki EM, et al. Effects of Bazedoxifene on BMD and Bone Turnover in Postmenopausal Women: 2 Yr Results of a Randomized, Double-Blind, Placebo, and Active-Controlled Study. J Bone Miner Res. 2008;23(4):525-535.
- Rosen CJ. Parathyroid hormone therapy for osteoporosis. ©2014UpToDate, Inc.
- Neer RM, Arnaud CD, Zanchetta JR, Prince R, Gaich GA, Reginster JY,et al. Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med. 2001;344(19):1434-41.
- Ficha técnica de Forsteo®. Disponible en http://www.ema.europa.eu/docs/es_ES/document_library/EPAR__Product_Information/human/000425/WC500027994.pdf
- Meunier PJ, Roux C, Seeman E, Ortolani S, Badurski JE, Spector TD, et al. The effects of Strontium Ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis. N Engl J Med. 2004; 350:459-468.
- Reginster JY, Seeman E, De Vernejoul MC, Adami S, Compston J, Phenekos C, et al. Strontium Ranelate reduces the risk of nonvertebral fractures in postmenopausal women with osteoporosis: treatment of peripheral osteoporosis (TROPOS) study. J Clin Endocrinol Metab. 2005; 90(5):2816-2822.
- Nota AEMPS 2007/17- Ranelato de Estroncio (Protelos®, Osseor®): riesgo de reacciones graves de hipersensibilidad. Disponible en: http://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/seguridad/2007/docs/NI_2007-17_protelos-osseor.pdf
- Nota AEMPS 04/2012: Ranelato de Estroncio (Protelos®, Osseor®): riesgo de tromboembolismo venoso y reacciones dermatológicas graves. Nuevas contraindicaciones de uso. Disponible en: http://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/seguridad/2012/docs/NI-MUH_04-2012.pdf
- Nota AEMPS 11/2013: Ranelato de Estroncio (Protelos®, Osseor®): riesgo de infarto agudo de miocardio. Disponible en: http://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/seguridad/2013/docs/NI-MUH_FV_11-2013-ranelato-estroncio.pdf
- Nota AEMPS 2/2014: Finalización de la revisión del balance beneficio-riesgo de ranelato de estroncio (Osseor®, Protelos®): restricciones de uso. Disponible en: http://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/seguridad/2014/docs/NI-MUH_FV_02-2014-ranelato-estroncio.pdf
- Nota AEMPS 9/2014: Ranelato de estroncio (OSSEOR®, PROTELOS®): calificado como medicamento de diagnóstico hospitalario. Información para profesionales sanitarios. Disponible en: http://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/seguridad/2014/docs/NI-MUH_FV_09-2014-ranelato.pdf.
- Watts NB, Diab DL. Long-term use of biphosphonates in osteoporosis. J Clin Endocrinol Metab. 2010; 95:1555-65.
- Whitaker M, Guo J, Kehoe T, Benson G. Bisphosphonates for osteoporosis. Where do we go from here?. N Engl J Med. 2012;366: 2048-2051.
- Black DM, Bauer DC, Schwartz AV, Cummings SR, Rosen CJ. Continuing bisphosphonate treatment for osteoporosis. For whom and for how long?. N Engl J Med. 2012; 366:2051-53.
- McClung M, Harris ST, Miller PD, Bauer DC, Davison S, Dian L, et al. Bisphosphonate therapy for osteoporosis: benefits, risks, and drug holiday. Am J Med. 2013;126:13-20.
- Black DM, Schwartz AV, Ensrud KE, Cauley JA, Levis S, Quandt SA, et al. Effects of continuing or stopping alendronate after 5 years of treatment. The Fracture Intervention Trial Long-term Extension (FLEX): a randomized trial. JAMA. 2006; 296:2927-38.
- Black DM, Reid IR, Boonen S, Bucci-Rechtweg C, Cauley JA, Cosman F, et al. The effect of 3 versus 6 years of zoledronic acid treatment of osteoporosis: a randomized extension to the HORIZON-Pivotal Fracture Trial (PFT). J Bone Miner Res. 2012; 27:243-54.
- Watts NB, Chines A, Olszynski WP, McKeever CD, McKlung MR, Zhou X, et al. Fracture risk remains reduced one year after discontinuation of risedronate. Osteoporos Int. 2008; 19:365-72.
- Diab DL, Watts NB. Bisphosphonate drug holiday: who, when and how long. Ther Adv Musculoskel Dis. 2013;5(3):107-111.
- Costa i Pagès J. Descanso en el tratamiento con bisfosfonatos: quién, cuándo y por cuánto tiempo. Butlletí d’informació terapéutica. 2014;25(4):21-9.
- Rosen HN. The use of bisphosphonates in postmenopausal women with osteoporosis. ©2014UpToDate, Inc.















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: