Biogen presentó en el Congreso de la Sociedad Internacional de Farmacoeconomía e Investigación de Resultados (ISPOR) 2018 una comunicación, titulada Access to orphan drugs in Spain: analysis of nusinersen’s case, para mostrar algunos de los factores que pueden permitir acelerar el acceso en condiciones de equidad para los medicamentos huérfanos en el sistema sanitario español. Cabe destacar que, como informó la por entonces directora de Farmacia, Encarnación Cruz, la fijación de precio y financiación de nusirersén llevó aparejada la aplicación de protocolos, que incluían los requisitos de inicio y fin de tratamiento, además de la creación de un registro para medir resultados en salud y el compromiso de la compañía de sufragar el coste de los tratamientos para aquellos pacientes que venían recibiendo el tratamiento por su participación en ensayos clínicos o por uso compasivo.
La compañía se refirió al proceso de precio y reembolso de este fármaco para el tratamiento de la atrofia muscular espinal (AME) con alteraciones en el cromosoma 5q, con una "solución integral para todas las autoridades sanitarias" (en referencia a las CCAA) que, dicen, "dio como resultado una reducción significativa del tiempo de reembolso y su reconocimiento por parte del Ministerio de Sanidad, Consumo y Bienestar Social de España".
En este sentido, Biogen destaca que, gracias a ese proceso, se logró "el 100% de acceso regional a través de las comunidades autónomas españolas en sólo cinco meses desde su lanzamiento al mercado", un hecho que, a ojos de esta compañía, lo convierte en "un caso de referencia de precio y reembolso en relación a futuros procesos en nuestro país". Marcio Machado, director de Market Access de Biogen, destaca, como principal beneficio del esquema aplicado, el "acceso equitativo para todos los pacientes españoles con AME al tratamiento".
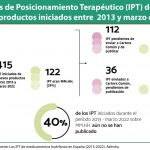
En este sentido, hacen referencia al dato de que, de los 58 medicamentos huérfanos aprobados por la EMA entre 2012 y 2016, sólo el 31% logró la obtención de precio y reembolso en nuestro país.
Los retos en evaluación económica
Durante la celebración de este congreso, Biogen ofrece una reflexión sobre los retos de la medición de la calidad de vida en el contexto de la evaluación económica y el reembolso de nuevos medicamentos, concretamente, en lo que respecta a las enfermedades raras, y a los diversos enfoques que se pueden adoptar para su abordaje. Este fue el tema central del simposio 'How should we measure Quality of Life impact in rare disease: Recent learnings from Spinal Muscular Atrophy'.
Sobre este tema ha hablado, para Biogen, Julio López-Bastida, profesor de la Universidad de Castilla-La Mancha, quien ha subrayado "las escasas pruebas disponibles en relación a la calidad de vida para cumplir con los requisitos de la evaluación económica", lo que, en su opinión, "dificulta la disponibilidad de tratamientos que pueden cambiar la vida de muchos niños con enfermedades raras". En su opinión, todos los agentes del sector de la salud deben reflexionar sobre la "importancia del acceso equitativo a nuevos tratamientos como algo fundamental para los enfermos y sus familias".


















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: