Marta Moreno, directora de Market Access & Public Affairs de Novartis Oncología, explica, en esta entrevista con Diariofarma, algunos de los pormenores del proceso de aprobación de precio y financiación en España de Kymriah, la nueva terapia celular (CAR-T) para el tratamiento de pacientes con leucemia linfoblástica aguda de células B refractaria y linfoma difuso de células grandes B recaído/refractario. Analiza, además, algunos de los últimos anuncios de la Dirección General de Farmacia.
Pregunta. En Novartis Oncología están de enhorabuena. Varios de sus medicamentos han obtenido decisión favorable de precio y financiación en el último tiempo, ¿no es así?
Respuesta. Así es, tenemos la gran suerte y la alegría de estar celebranda tres aprobaciones recientes. En diciembre, la de Kisqali (ribociclib), con dos nuevas indicaciones para cáncer de mama metastásico que eran muy esperadas por las pacientes. Al final de año, el Ministerio nos aprobó también el primer CAR-T, Kymriah (tisagenlecleucel), que hemos lanzado el pasado mes de enero, siendo la primera terapia génica a la que se le han aprobado además dos indicaciones: una en leucemia linfoblástica aguda de células B refractaria, en recaída post-trasplante, y otra en linfoma difuso de células grandes B recaído/refractario tras dos o más líneas de tratamiento sistémico. Por último, señalar la decisión favorable, en la reunión de la Comisión Interministerial de Precios (CIPM) de febrero, para Rydapt (midostaurina), el primer medicamento en 25 años para leucemia mieloide aguda en pacientes con mutación de FLT3 y mastocitosis, que viene además de la mano de un informe de la red europea EunetHTA, que avala el hecho de que viene a cubrir una necesidad terapéutica. Cabe destacar, a este respecto, que en torno al 30% de los pacientes con leucemia mieloide aguda tienen esta mutación.
P. Los especialistas hablan maravillas de los CAR-T...
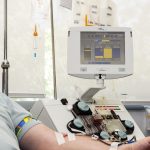
R. En el caso de nuestro producto, Kymriah, tenemos que decir que ha demostrado una supervivencia global que ronda el 90% en leucemia linfoblástica aguda. Una novedad importante tiene que ver con el proceso que se sigue para este tratamiento, desde la realización de la linfoaféresis, a la reprogramación de las células que hacemos en New Jersey, para la posterior elaboración de Kymriah, para infundírselo después al paciente. Y lo más relevante es que los pacientes a los que se les va a administrar este medicamento tenían muy mal pronóstico, tras haber fracasado a dos trasplantes. Una situación más dramática aún si pensamos en que hay menores afectados. Ahora tenemos en Estados Unidos a niños que llevan siete años curados. En España los hay que llevan dos años, tras haber participado en los ensayos clínicos. No obstante, somos prudentes, y hablamos aún de potencial de curación, ya que necesitamos más datos a largo plazo.
P. Llama la atención que, pese al alto precio que se le presupone a estas nuevas terapias, la decisión favorable ha sido bastante rápida, algo que no suele ser muy habitual en medicamentos de alto impacto. ¿Cuáles han sido las claves de las negociaciones con el Ministerio?
R. Se puede decir que estamos en tiempos de difícil acceso, donde se nos está empezando a demandar coste-efectividad, se están comenzando a aplicar nuevos modelos de precio y financiación... Pero sí, tanto con nuestro CAR-T, como con ribociclib, hablamos de menos de dos meses, de tiempos récord. El caso de midostaurina ha estado más en línea con los plazos habituales que se manejan ahora. Pienso que la clave ha sido ir de la mano con el Ministerio. Por nuestra parte, hemos tratado de ser muy innovadores en la manera de plantear modelos que permitan a las autoridades sentirse cómodas. Hemos estado en contacto con ellas en todo momento. Se trata de enfermedades para las que no hay nada, que además, en el caso del CAR-T, introducen una innovación importante.
P. ¿Defina ese "ir de la mano"?
R. Comenzamos a hablar con el Ministerio de Sanidad un año y medio antes de la aprobación del CAR-T, para informarles de que la terapia venía. Cuando nos preguntan en la central cuál ha sido la clave, les decimos que ese diálogo temprano. En ese transcurso, hemos hablado con muchos agentes, ya que había muchas dudas. Había que hablar con la EMA, con la Aemps, ya que había muchas cosas que ellos mismos no sabían. Hemos trabajado con la Organización Nacional de Transplantes (ONT). En la relación con el Ministerio, se puede hablar de que hemos co-creado un modelo. Y todo ello en un contexto marcado por la sucesión de tres ministros de Sanidad, con sus correspondientes directores de Farmacia. El caso es que desde el primer momento supieron ver que estábamos ante una terapia disruptiva, innovadora, que cura cánceres a pacientes con muy mal pronóstico, como decía antes.
P. Pese a lo controvertidos que son siempre los precios altos…
R. Pero es que en cuestión de precios también hemos introducido una innovación importante. Se trata de un modelo híbrido que es la primera vez que se hace a nivel central. Un modelo en el que la directora de Farmacia, Patricia Lacruz, se ha implicado personalmente, porque sintió que tenía que ser así. Prácticamente, cada semana íbamos al Ministerio a debatir sobre el proyecto. Sobre si los precios son altos o bajos… cuando en su momento se hablaba de unos 320.000 euros por tratamiento, nos tuvimos que preguntar si eso era realmente caro o barato, en función de lo que aporta este tratamiento, y partiendo de que los riesgos tenían que ser asumidos por ambos.
P. Hablaba de un modelo híbrido y de compartir riesgos. ¿Puede explicarlo?
R. Lo llamamos modelo híbrido porque es un modelo que combina un pago por resultados con una innovación a nivel financiero. En cuanto a los pagos, se ha acordado que una parte se haga en el momento de la infusión del tratamiento, ya que hay una inversión grande, que Novartis hace para traer la innovación a los pacientes. Después, en función de la variable establecida, se hace el segundo pago. Nosotros planteamos que se basara en una revisión de la efectividad a los 12 meses, pero el Ministerio nos dijo que no, que a los 18. Eso implica que vamos a estar 18 meses sin cobrar una parte del coste del tratamiento, lo que nos ha obligado a cambiar nuestro sistema de cobro. Hemos tenido que co-crear, también, un modelo de facturación.
P. Se puede decir entonces que la rapidez en la aprobación tiene que ver, también, con esta capacidad para ser flexibles, ¿no?
R. Yo pienso que sí. Fuimos con el competidor a la misma negociación, y pienso que nuestra flexibilidad, además de haber iniciado pronto el diálogo, ha sido la clave para que nuestro medicamento ya esté aprobado. Nuestra disposición a co-crear un modelo ha sido fundamental. Yo quiero ponerlo en valor porque hay que tener en cuenta que trabajamos en un modelo europeo, donde los precios de España pueden afectar a otros países.
P. Otro aspecto que sin duda ha sido novedoso es que ustedes, como compañía, determinan si los centros están cualificados para la administración de una terapia. ¿Cómo explica eso?
R. Nos sentimos con la obligación de garantizar que el hospital cumple todos los requisitos para que se pueda fabricar el CAR-T y dé los resultados que esperamos. Al principio tampoco se entendía, ha supuesto un cambio de modelo, en un proceso en el que hemos aprendido mucho juntos.
P. ¿Qué opina del proceso para la selección de centros y cómo está siendo el periodo de in-pass hasta que ya estén cualificados?
R. En su momento nos preocupó saber qué iba a ocurrir en el periodo que iba entre la aprobación de la EMA y la asignación de precio y reembolso, porque había pacientes esperando un tratamiento. A partir de ahí se abrió un debate relacionado con el modelo para la administración de estas terapias, y estamos a la espera de ver en qué centros se aplican finalmente. La suerte es que tenemos varios ensayos clínicos nuevos con esta terapia y para poder hacer los ensayos teníamos que certificar a esos centros. Dijimos al Ministerio los que habíamos elegido y fuimos de la mano… Así, los pacientes que se vayan diagnosticando estarán cubiertos. Parece que finalmente se ha optado por una red de unos 10 centros. Lo interesante aquí es que las CCAA que tengan más centros, van a tener que soportar más coste. Se nos solicitó facturar al hospital que deriva, lo que nos ha llevado también a crear un modelo de facturación que cobre al centro derivador. Lo he tenido que defender internamente, basándome en lo que nos mueve: garantizar que a todo paciente que lo necesita se le va a administrar el tratamiento.
P. Para concluir con todo el proceso de aprobación de los CAR-T, quería preguntarle por las terapias académicas en investigación. El Ministerio las presentó como una alternativa en plena negociación, pero parece que esa visión se ha difuminado. ¿Se ve compitiendo con ellas algún día?
R. La información que yo tengo me hace pensar que no somos competidores. En cuanto a utilizar esa especie de presión para la negociación… Creo sinceramente que es muy difícil competir con nosotros con el precio que tenemos ahora, que es muy competitivo. Y de cara a esa posible competencia, me parecerá bien siempre que se cumpla el procedimiento legal, que demuestren, a través de ensayos clínicos, su eficacia y seguridad. Es cierto que se están usando en algunos pacientes, pero cuando no hay alternativas. La clave es que se sigan los procedimientos y que garanticen lo que nosotros garantizamos, sobre todo la seguridad del paciente.
P. ¿Temen un escenario de este tipo?
R. Pues es que hay aspectos como la capacidad de fabricación, o las indicaciones a las que van a ir que son determinantes. Pero no hablaría de temor, siempre que las autoridades se decidan por buscar la excelencia, como se hizo, por ejemplo, con los biosimilares, y que se asegure que todos cumplimos las normas y garanticemos la seguridad a los pacientes.
P. Aprovecho ya para preguntarle por otras medidas que se han lanzado desde la Dirección General de Farmacia, como la puesta en marcha de Valtermed, para medir la efectividad y poder pagar por resultados. ¿Qué opinión le merece?
R. En líneas generales, hay muchas cosas que suenan bien de los recientes anuncios desde Farmacia. Algunas nos ilusionan. Con respecto a un Valtermed, para aplicar modelos de pago por resultados, que es a lo que vamos, yo creo que es fundamental que como país nos dotemos de estos sistemas, para poder medir todo lo que hacemos, para medir el coste real y los resultados. No obstante, reconozco que sigo expectante para ver cómo se plasma. Me gustaría, por ejemplo, un Valtermed en el que se registre todo lo que pasa en los hospitales españoles, y que incluso se vaya más allá de las cuestiones puramente clínicas, y se puedan medir también los ahorros que generamos por haber curado, por haber evitado unas hospitalizaciones… El modelo me gusta, pero se ha hecho rápido y hay que ver cómo se lleva a la práctica, porque ahora no tenemos información suficiente
P. Más reciente aún es la creación del Comité Asesor para la Financiación de la Prestación Farmacéutica, así como el nombramiento de sus miembros. ¿Qué piensa de eso?
R. Pues me pasa un poco lo mismo, estoy a la expectativa. La aplicación del coste-efectividad me parece bien. Nosotros siempre lo hemos planteado. Pero es cierto que nos gustaría ir de la mano y que la Administración cuente con la industria, y, como hemos hecho con nuestra CAR-T, co-crear juntos el modelo.

















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: 