La Organización Médica Colegial (OMC) ha querido hacer pública su posición en lo que respecta al acceso a los futuros tratamientos y vacunas para la Covid-19, para lo que ha elaborado un informe con algunas recomendaciones.
La primera pasa por "avanzar un debate sobre las prioridades en la aplicación de vacunas" en el caso "probable" de que las primeras unidades que lleguen al mercado no den para cubrir a toda la población. En este sentido, llaman a incorporar "la vulnerabilidad y el mayor beneficio en salud a medio plazo" como los dos principales criterios sobre los que priorizar.
Asimismo, consideran necesario "gestionar anticipadamente las condiciones de propiedad y patentes que determinarán el precio a pagar" y, además, "asegurar que sean coste-efectivas". En este sentido, consideran que "si la investigación en estas vacunas se está desarrollando bajo fórmulas de colaboración público-privada en muchos casos, no debería permitirse que únicamente la parte privada patentase los productos derivados del avance en el conocimiento".
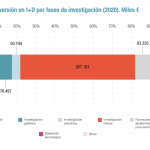
La OMC cree que hay que abordar también "el reto de fomentar una producción autónoma, segura y soberana de vacunas y medicamentos, estimulando cadenas completas y acopladas de investigación, desarrollo, innovación, producción y utilización". Todo eso supone, no obstante, "una auténtica inversión en tejido científico y económico de alto valor añadido".
Llaman a establecer "estrategias que marquen la relación entre los proveedores de las materias primas, los fabricantes de las vacunas y los países", para asegurar la accesibilidad a las mismas. Ponen como ejemplo la iniciativa de la Comisión Europea.
En el marco de las ayudas que están poniendo en marcha los gobiernos, consideran que las dirigidas a encontrar una solución en el ámbito de la terapéutica "debe ser considerada como un instrumento fundamental para la prevención de segundas y terceras oleadas de esta pandemia".
Sobre los tratamientos conocidos hasta ahora, destacan que "algunos son moléculas de nuevo desarrollo". "Sin embargo", añaden, "la mayoría son usos nuevos de medicamentos ya autorizados en otras indicaciones". En torno a éstos, señalan, se está generando una gran cantidad de información que debe ser "analizada, contrastada y verificada", por lo que consideran "más necesaria que nunca una Agencia que recoja toda esta información, y que asegure que esté disponible y que sea de fácil acceso para los profesionales sanitarios. De alguna manera, ésta es la labor que ha estado realizando hasta ahora la Agencia Española de Medicamentos y Productos Sanitarios (Aemps) en España.
















 Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia:  Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados:
Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados:  Margarita de la Pisa, eurodiputada de Vox.:
Margarita de la Pisa, eurodiputada de Vox.: