El Gobierno de España considera que el interés comercial de los laboratorios está vinculado al retraso de la autorización de fármacos para el tratamiento de enfermedades raras en nuestro país. “En definitiva, son las compañías farmacéuticas las que deciden cuando quieren comercializar en base a su interés comercial”, asegura el Ejecutivo en una respuesta escrita a una pregunta planteada por el grupo Ciudadanos en el Congreso de los Diputados.
El escrito, presentado por los diputados Inés Arrimadas y Guillermo Díaz, demandaba al Gobierno conocer tanto la posición de España en relación a la clausula Sunset, como las medidas que está poniendo en marcha para acelerar los trámites y atajar el problema de estos retrasos, evitando así el perjuicio que se está causando tanto a los pacientes como a sus familias.
El Gobierno en su argumentación recurre a la denominada clausula Sunset que forma parte de la legislación europea y por la cual, la autorización de comercialización de un fármaco dejará de ser válida si este no se comercializa en ningún Estado miembro en los tres años siguientes a la concesión de la autorización o si el medicamento se retira del mercado durante tres años consecutivos
Por ello, el Ejecutivo asegura que “no existe ninguna obligación para los titulares de la comercialización de medicamentos con autorización centralizada para comercializar en un número concreto de mercados de la UE, y con solo comercializar en un país en tres años es suficiente”. Es por ello que indican que es “el interés comercial” el que basa la decisión de las compañías de comercializar un medicamento.
El Gobierno indica que dentro de la Estrategia de Farmacéutica se trabaja para que “los titulares de la comercialización de los medicamentos comercialicen en todos los mercados de la UE lo antes posible”, e indica que por parte de las compañías existe una predisposición a esta comercialización, “pero no inmediatamente en todos los mercados, sino en un período de dos años”.
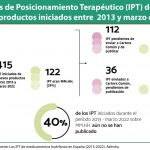
Fuera del plano europeo, el Gobierno argumenta que en España se están dando pasos positivios como son la mejora de los tiempos de elaboración de los ITP “los datos sobre de los Informes de Posicionamiento Terapéutico (IPT) han mejorado sustancialmente respecto a períodos previos desde la creación de la REvalMed, asegura el Gobierno. Así, "el tiempo de elaboración desde opinión positiva hasta adopción de IPT se sitúa ya en el primer semestre de 2022 en tiempos inferiores a 2018 y un 16% inferior a 2019. Si tenemos en cuenta el tiempo desde opinión positiva hasta resolución de financiación, la reducción de tiempo es el 40% respecto a 2020 y del 36% respecto a 2019".
Igualmente recuerda que los informes de Posicionamiento Terapéutico se empiezan a elaborar “cuando el laboratorio comunica la intención de comercialización”. En ese sentido indica que desde la creación del Grupo de Coordinación de la REvalMed el 20 de octubre de 2020, se han priorizado 188 IPT, 104 para nuevos medicamentos y 84 de nuevas indicaciones de medicamentos ya autorizados. 28 de los 104 nuevos medicamentos (27%), aún no han comunicado intención de comercialización, en el caso de los medicamentos huérfanos el porcentaje es del 26% (8 de 31).
El número de IPT adoptados en 2022 es de 60, “considerando además que son datos a 31 de agosto de 2022, igualando casi el número máximo de IPT adoptados/año, desde 2013. De los 496 IPT que se han adoptado desde 2013, 133 (26,8%) se han adoptado desde la fecha de creación de la red”.
En relación con la demora el Ejecutivo señala que “el tiempo medio desde la autorización de la CE hasta que el laboratorio solicita la comercialización en nuestro país, y se le asigna un código nacional registrándose así en la Agencia Española de Medicamentos y Productos Sanitarios (Aemps), es de 180,3 días”.
Igualmente, “el tiempo medio desde que se inicia el estudio de financiación y precio hasta que el laboratorio titular presenta el dossier con la primera oferta de precio es de 107,3 días. Cabe destacar que al menos el laboratorio presenta 2 ofertas, siendo de 3 a 5 el número de ofertas que los laboratorios presentan en cada uno de los expedientes”.
Por ello, la respuesta del Gobierno concluye que “aun considerando estas demoras por parte de los laboratorios se están llevando a cabo medidas para mejorar el acceso a los medicamentos huérfanos que realmente puedan aportar un beneficio relevante para los pacientes, entre ellas la valoración de la incertidumbre clínica por medio de acuerdos de financiación innovadores”.
El Ejecutivo recuerda además que la Estrategia de Enfermedades Raras se encuentra actualmente en proceso de evaluación, “lo que permitirá conocer la situación en relación a sus objetivos y orientar aquellos que requieran una posible actualización”.


















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: 