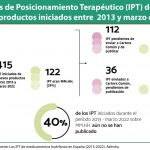
Farmaindustria valora “muy positivamente” que la Audiencia Nacional (AN) haya declarado la nulidad “de pleno derecho” del Plan para la consolidación de los Informes de Posicionamiento Terapéutico (IPT) de los medicamentos del Sistema Nacional de Salud.
La patronal ha señalado que la sentencia, que ha atendido todas las alegaciones presentadas en el recurso interpuesto, “supone una oportunidad de revisar este procedimiento en España”, formulando uno nuevo que respete la legalidad y con el consenso de todos los agentes.
Además, la directora del Departamento Jurídico de Farmaindustria, Ana Bosch, ha señalado en declaraciones exclusivas a Diariofarma, que la sentencia “es el triunfo de la legalidad y del Estado de Derecho” por lo que supone en relación con las garantías para la elaboración de las normas. Según esta experta, responsable del recurso presentado, todas las cosas se pueden hacer y “se puede cambiar la perspectiva, pero hay un marco que cumplir”, por lo que, si algo no se ajusta a la ley, se cambia. En el caso de los IPT, Bosch insiste en que la ley “es muy clara al atribuir la competencia a la Aemps y atribuye a los IPT un contenido exclusivamente científico y no económico” y eso no se puede modificar con un plan.
Por ese motivo, el núcleo argumental del recurso presentado por Farmaindustria fundamentaba que el Plan “es una auténtica norma reglamentaria, es una disposición de carácter general a la que se ha denominado plan para encubrir su verdadera naturaleza”. Y como recuerda esta experta, los reglamentos, reales decreto, son competencia del Consejo de Ministros.
Bosch explica a Diariofarma que una cuestión muy relevante planteada en su recurso y que no ha sido valorada por el tribunal se refería al ámbito de transparencia de los evaluadores que forman parte de los nodos. “Creemos que es importante que las personas que intervienen, que toman decisiones y que tienen
trascendencia pública, sean conocidas”, explica la directora jurídica de la patronal, quien lo justifica en que es necesario identificar a las personas que actúan en un procedimiento, como sucede con cualquier responsable público, para “asegurar la independencia y que la resolución se adopta con todas las garantías”. Además, tal y como recuerda, “existe la facultad de recusación y la obligación de abstención cuando puede haber un conflicto de intereses para garantizar que el resultado cumpla con todos los requisitos de independencia”.
La Justicia tumba REvalMed al anular el Plan para la consolidación del IPT
La representante de Farmaindustria también recuerda que a lo largo de los últimos tiempos, han venido proponiendo, de manera constructiva, a la Administración, diversos cambios en los procedimientos para evitar perjuicios a los pacientes y acelerar los plazos de acceso. A este respecto, señala que el Plan establecía como requisito para la financiación la existencia de un IPT, cuando lo lógico es que haya algunos casos, como nuevas indicaciones, que puedan ser exceptuados de la necesidad de un informe. De lo contrario, se alargan los plazos “de un proceso que de por sí ya es lento” y hace que no se cumpla con la Directiva de Transparencia, señala.
Tras la sentencia, el Ministerio de Sanidad dispone hasta primeros de octubre para presentar el recurso de casación.
Reforma urgente
España está viviendo en los últimos años una preocupante situación en materia de disponibilidad de fármacos. “En nuestro país los pacientes sólo tienen acceso a un 58% de los nuevos tratamientos aprobados en la Unión Europea y esperan 629 días de media, según el último informe Indicadores de acceso a terapias innovadoras en Europa 2022 (W.A.I.T. Indicator)”, asegura la patronal.
Por eso, Farmaindustria viene reclamando que la situación actual requiere una reforma urgente del sistema de precio y financiación en España para que los pacientes tengan un acceso a los nuevos medicamentos y terapias en términos de plazos y disponibilidad en línea con las mejores prácticas de los principales países europeos.
Las características principales serían:
- Más predictibilidad, claridad y objetividad en los procedimientos y decisiones de precio y financiación de medicamentos innovadores. Las reformas necesarias en estos procedimientos deberían permitir que se cumpla el plazo establecido en la legislación para la decisión sobre financiación (180 días, frente a los 629 días de media actuales) y lograr tasas de financiación de nuevos medicamentos autorizados más cercanas a las de nuestros vecinos europeos.
- Separación clara de la evaluación terapéutica de la económica de los medicamentos innovadores (que se realiza durante el proceso de financiación) y consideración del valor social total que aporta el medicamento, es decir, incluyendo ahorros sanitarios y no sanitarios e impacto sobre la productividad y el empleo.
- Establecimiento de un sistema de acceso temprano de los fármacos que aporten mayor beneficio clínico, con participación de médicos y pacientes y con un precio provisional que se ajuste luego en base a resultados.
- Identificación de las necesidades médicas no cubiertas y mecanismos específicos de precio y financiación para atender las enfermedades raras.
- Seguimiento y mayor coordinación entre las comunidades autónomas para asegurar un acceso equitativo en todo el SNS a los medicamentos incluidos en la prestación, con indicadores de acceso que objetiven la situación y permitan corregir desviaciones.
- Reconocimiento de la innovación incremental, en cuanto a su potencial para mejorar el tratamiento de enfermedades y para facilitar el uso adecuado del medicamento.
Farmaindustria reitera, asimismo, su compromiso con el diálogo y trabajo conjuntos con el Ministerio de Sanidad para fijar lo antes posible el mejor sistema de evaluación y financiación de la innovación biomédica por el bien de los pacientes y del SNS.













 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: