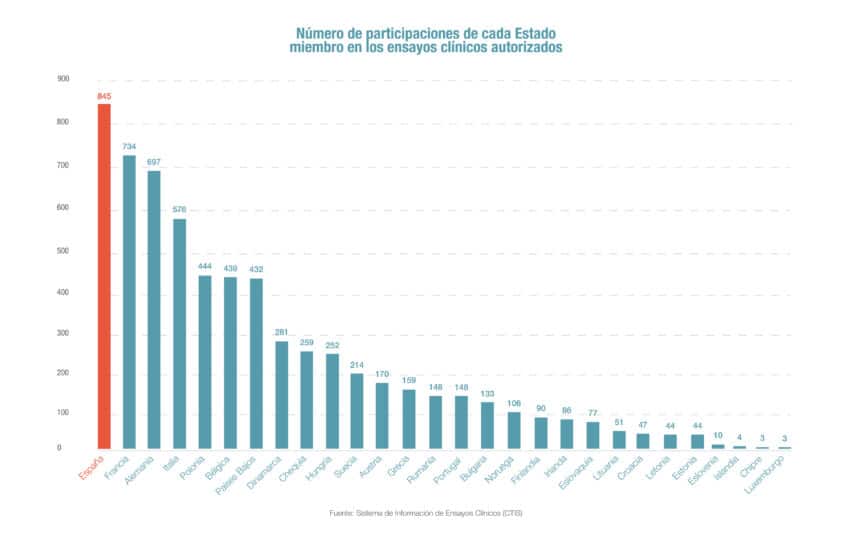
Los centros españoles participan en 845 ensayos clínicos que se realizan en la Unión Europea (1.944), un 43% del total, lo que sitúa a España en el primer país de Europa en este ámbito, por delante de Francia con 734 participaciones en ensayos y Alemania con 697, según los datos que por primera vez de forma conjunta a presentado la Agencia Europea del Medicamento (EMA). Igualmente, España también lidera la coordinación y autorización de los ensayos multinacionales dentro de la Agencia Europea de Medicamentos. Así, a través de la Agencia Española de Medicamentos (Aemps), nuestro país fue el responsable de coordinar la autorización como Reporting Member State de 350 ensayos clínicos en la Unión Europea, por delante de Alemania con 314 y Francia con 248.
“Nuestro país fue el primero de la Unión Europea en adoptar el Reglamento Europeo de Ensayos Clínicos, con el Real Decreto 1090/2015, y ello ha supuesto la simplificación y armonización a nivel nacional de los procedimientos antes que en ningún otro Estado miembro; la reducción de los tiempos en la puesta en marcha de los estudios; un incremento de los ensayos en fases tempranas, que son los que requieren de un mayor nivel de complejidad, y un mayor compromiso con la investigación en enfermedades raras y en población pediátrica”, destaca Amelia Martín Uranga, directora del Departamento de Investigación Traslacional de Farmaindustria.
Según datos de la Aemps, recogidos en el Registro Español de Estudios Clínicos (REEC), más de la mitad de los ensayos clínicos (58%) que se ponen en marcha en España son de fases tempranas (I y II); uno de cada cuatro ensayos está enfocados en enfermedades raras; y los ensayos clínicos pediátricos suponen ya hasta un 15% de todos los que se ponen en marcha en nuestro país.

Sin embargo, desde Farmaindustria señalan que “corremos el riesgo de quedarnos atrás si no implementamos mejoras que hagan más atractiva la inversión en investigación clínica en nuestro país”. La competencia entre países europeos para albergar ensayos clínicos en sus hospitales ha crecido en los últimos años. “Los datos del CTIS (sistema de registros centralizados plenamente en marcha desde 2023) reflejan un número creciente de ensayos en países que hasta ahora no tenían protagonismo en este campo, como Croacia, Estonia, Letonia, Lituania o Rumanía”, asegura. “También tenemos que estar preocupados como región europea, ya que hay mucha competencia en otras partes del mundo, especialmente EEUU y la región Asia-Pacífico, que están haciendo una apuesta muy importante por la investigación clínica”, señala Martín Uranga.
Retos y prioridades
En esta línea, la directora de Investigación Clínica y Traslacional de Farmaindustria destaca una serie de retos y prioridades que ha marcado la Asociación en este año para conseguir que España se convierta en un verdadero hub de innovación biomédica.
“Por ejemplo, España es uno de los mejores países en ensayos en fases I y II, y eso es una gran noticia para los pacientes, porque entrar a probar un fármaco en una fase temprana es una puerta a la esperanza para pacientes con enfermedades graves. Lo que pasa es que ya hay países en Europa que han apostado por un fast track (procedimiento agilizado) para ensayos en fase I, lo que puede desplazar la investigación fuera de España. Desde Farmaindustria hemos pedido que exista también en nuestro país este mecanismo acelerado”, asegura la responsable de Farmaindustria.
En todo este contexto y para afianzar el liderazgo de España, Farmaindustria ha diseñado un plan de actuación para 2024, que comprende varias líneas de actuación. Entre ellas, el fomento la investigación clínica en los centros Atención Primaria y en colaboración con los hospitales; el impulso de los ensayos clínicos en red; avanzar en elementos descentralizados de los ensayos; seguir trabajando con los pacientes y con los servicios de Farmacia Hospitalaria; y tratar de agilizar y reducir la burocracia en la gestión de esta investigación.
“Para todo ello, es fundamental la colaboración y cooperación con otros stakeholders con los que la Asociación ya viene trabajando, como la Agencia Española de Medicamentos, los Comités de Ética de la Investigación con medicamentos, investigadores, centros hospitalarios, pacientes y gestores de investigación, entre otros agentes. Sin duda, parte del éxito del trabajo desarrollado estos últimos años radica en esta colaboración público-privada, que ahora más que nunca hay que intensificarla para afianzar el liderazgo”, concluye Martín Uranga.



















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: