España ha vuelto a convertirse en 2024 en el país con la mayor capacidad de atracción de investigación clínica de medicamentos de la Unión Europea. Según el Registro Español de Estudios Clínicos (REec), la Agencia Española de Medicamentos y Productos Sanitarios (Aemps) autorizó el año pasado un total de 930 estudios, alzándose así como la agencia reguladora europea que más ensayos clínicos ha aprobado, por delante de las de países como Francia o Alemania.
“Este liderazgo se sustenta en la sólida infraestructura del Sistema Nacional Sanitario y la alta cualificación de sus profesionales sanitarios, el compromiso y la colaboración de los pacientes y la industria farmacéutica, y la labor de la Aemps favoreciendo un marco regulatorio ágil y flexible”, aseguran desde la Agencia.
“El trabajo coordinado, colaborativo y continuo entre estos agentes es el que ha convertido a nuestro país, un año más, en uno de los referentes a nivel mundial en ensayos clínicos”, indican, al tiempo que recuerdan que este hito se cumple además “en un año marcado por la adaptación al Reglamento Europeo de Ensayos Clínicos, en el que la Aemps ha realizado un importante esfuerzo por facilitar la transición al nuevo Sistema de Información CTIS (Clinical Trial Information System), y en el año en el que REec registraba la cifra récord de los 10.000 ensayos clínicos publicados”.
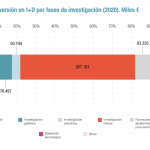
Por patologías, España lidera la investigación con medicamentos destinados a tratar el cáncer en la UE, con un total de 336 ensayos en oncología. A nivel nacional representa un 37,6% del total de los estudios autorizados, seguida de patologías del sistema inmunitario y sistema nervioso, con un 8,6% y 7%, respectivamente.
Nuestro país también es líder europeo en investigación con medicamentos de terapia avanzada, con 52 ensayos autorizados en 2024, gracias al expertise de sus evaluadores y a las estructuras de apoyo específico en los centros de referencia para la administración y el seguimiento de este tipo de terapias. Es destacable el creciente protagonismo de los medicamentos biotecnológicos en el manejo de enfermedades graves y discapacitantes en consonancia con el interés estratégico de la biotecnología para la UE. Un 22% de los ensayos clínicos realizados en España, además, se centraron en las enfermedades raras.
La Aemps ha autorizado en 2024 un total de 770 estudios multinacionales, lo que sitúa a España a la cabeza de este tipo de ensayos. Nuestro país ocupa el primer lugar evaluando como Estado de referencia (RMS, por sus siglas en inglés) en un 28% de los estudios.
En cuanto al carácter comercial de estos estudios, un 17% de los autorizados en 2024 son no comerciales, es decir, están promovidos por una institución académica u hospitalaria, una sociedad científica o investigadores clínicos, un porcentaje que se ha mantenido en las cifras previas a la transición del nuevo reglamento, lo que demuestra que la investigación independiente ha conseguido adaptarse también a los requisitos regulatorios y al nuevo sistema CTIS.
Asimismo, 2024 se ha caracterizado por ser el año en el que la Aemps ha puesto en marcha por primera vez un procedimiento de evaluación acelerada o fast-track. Se trata de un ensayo clínico en fase I de una vacuna que se va a llevar a cabo en los hospitales universitarios madrileños de La Paz, La Princesa y Puerta de Hierro, así como en otros centros hospitalarios de Estados Unidos y Australia.
La apuesta de la AEMPS para mantener el liderazgo español en ensayos clínicos pasa también por los tiempos de autorización. El sistema de evaluación única CTIS, válido para toda la UE, implicó un aumento en los plazos en nuestro país debido a la adaptación a la coordinación europea pero, desde la entrada en aplicación del Reglamento 536/2014 en febrero de 2022, la Aemps ha mejorado el plazo medio para la autorización de estos estudios, pasando de 120 a 108 días de media. La Agencia trabaja con el objetivo de volver a los plazos anteriores al reglamento (en torno a 90 días).
















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia:
Un comentario
Enhorabuena para todos esos profesionales mal pagados y poco reconocidos de la AEMPS, que se dejan cada día la piel para contribuir a que este país sea líder en investigación clínica y se beneficien de ello los pacientes españoles. Y para el resto de agentes del sistema sanitario español, que hacen que este país brille en Europa cuando hablamos del desarrollo de terapias de gran necesidad médica.