La Organización para la Cooperación y el Desarrollo Económico (OCDE) ha publicado los resultados de un estudio, titulado 'Using Routinely Collected Data to Inform Pharmaceutical Policies', basado en una encuesta en la que han participado 26 países miembros de esta organización de la Unión Europea. Los resultados indican que, a pesar de que muchos de estos países, entre los que no aparece España, recogen sistemáticamente datos de práctica clínica real, éstos no disponen de la capacidad suficiente para explotarlos y tenerlos en cuenta en la toma de decisiones asociada a la gestión de la prestación farmacéutica.
Según los resultados de la encuesta, 25 de los países participantes, casi el 100%, recopilan de forma rutinaria datos relacionados con los medicamentos prescritos y dispensados. La mayoría de ellos, además, lo hacen a nivel nacional y los tienen disponibles en una base de datos única. Ejemplos de ello son Francia, República Checa o Australia, para sus modelos de reembolso a las farmacias, y también citan las bases de datos para la prescripción desarrolladas por Estonia, Finlandia, Noruega o Suecia.
Portugal, en cambio, tiene dos plataformas separadas, una para cada uno de estos fines. En otros países, como Bélgica, Italia, Luxemburgo o Rumanía, los datos se registran a nivel regional o por las aseguradoras responsables de la prestación, aunque después son agregados a nivel nacional, mientras que hay casos, como los de Malta, Israel o Estados Unidos, con sistemas de aseguramiento, que cuentan también con diversas bases de datos que operan de manera separada. A este respecto, cabe destacar que la agregación de la información, como apuntan desde la OCDE, es clave para poder llevar a cabo investigaciones que puedan arrojar resultados significativos y representativos, una situación que se ve dificultada cuando lo que se da es la dispersión.
Otro aspecto importante, de cara a la posibilidad de explotar esos datos, es el acceso que existe a ellos. En las conclusiones del estudio puede apreciarse que en torno a la mitad de los países participantes en la encuesta admiten que el acceso está restringido a organismos gubernamentales y responsables de la custodia de datos. "En muchos casos, son las instituciones implicadas en la decisión las que tienen acceso a esos datos", apuntan. Solo en algunos países la información está disponible para otros agentes, como es el caso de los Commisioning Groups en Inglaterra o los GPs en Holanda, así como la industria farmacéutica en Australia, y todos los agentes interesados en Francia, siempre que la investigación se haga de acuerdo con el interés público y los resultados se pongan a disposición de las autoridades.
Los países registran, pero para usos muy concretos
Pese a lo dicho, la OCDE afirma claramente que, "a la vez que se sabe que los datos están siendo recogidos, éstos no están siendo usados sistemáticamente para desarrollar políticas farmacéuticas informadas. Principalmente, el uso que están dando los países participantes en la encuesta a esta información está dirigido a la monitorización del consumo y del gasto (22 países), a corroborar el cumplimiento de las guías clínicas (18), así como al control de calidad en la prescripción y el comportamiento en este ámbito (15)". Es verdad, no obstante, que hasta la mitad de ellos han admitido haberlos tenido en consideración para la realización de estudios de coste-efectividad y evaluaciones de efectividad comparada.
Otra cosa, explican, es el impacto que tienen los resultados de estos estudios basados en los datos recopilados en la vida real en el desarrollo de la política farmacéutica. "La evidencia que se está generando con esos estudios observacionales y datos de vida real está siendo usado más como información de base para la evaluación de tecnologías que para guiar las decisiones sobre la autorización de comercialización por parte de las agencias regulatorias", señalan, y lo achacan, por una parte, al hecho de que estos datos estén disponibles una vez que el producto ya está en el mercado y, por otro, por la "jerarquía" que se se le otorga aún a lo que llaman "la evidencia tradicional", es decir, la que procede de la investigación clínica convencional.
Ejemplos de los usos que sí se están dando a estos datos son la vigilancia de efectos adversos una vez que los medicamentos ya han sido puestos en circulación, que puede dar lugar, incluso, a la retirada del mercado, cuando no a la obligación de una modificación de la ficha técnica o una alerta de seguridad, o la revisión de evaluaciones previas, que puede llevar a cambiar el estatus de un fármaco, como ha ocurrido en Francia con las benzodiacepinas. En el país galo, así como en Australia, Estonia y Finlandia los resultados de estudios observacionales han podido influir en la decisión de precio y financiación, y en otros como Reino Unido, han servido para la revisión de guías clínicas, como ha ocurrido con el trastorno por déficit de atención e hiperactividad.
Lejos del aprovechamiento máximo
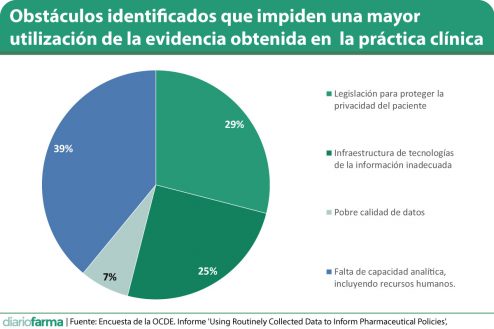
No obstante, como ya se ha dicho anteriormente, los países reconocen que el aprovechamiento de los datos que se están generando sigue lejos de su máximo. El 39% lo explica por una carencia de recursos analíticos (técnicos y humanos), el 29% lo achaca, principalmente, a la normas de protección de datos personales, que limitan la posibilidad de compartir información del paciente, el 25% se refiere a carencias en la infraestructura tecnológica, y un 7% alude a la pobre calidad de la información.
Con todos estos datos sobre la mesa, la OCDE recuerda que existe ya un consenso emergente en relación a la necesidad de explotar el valor de la información para mejorar resultados en salud y hacer un uso más eficiente de los recursos, y alude de forma específica a los medicamentos. A este respecto, opinan que "el precio y reembolso de los nuevos medicamentos están determinados antes de la entrada del medicamento en el mercado, basándose en datos de riesgo-beneficio procedentes de los ensayos clínicos". "El uso de esas medicinas en la práctica clínica diaria da lugar en ocasiones a la aparición de efectos que no se habían previsto, y a menudo revela la diferencia existente entre la eficacia y la efectividad. Por eso, la realización de estudios observacionales retrospectivos, usando métodos analíticos apropiados, puede contribuir a una evaluación del verdadero valor que aportan los medicamentos", concluyen.














 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: