La Fundación Weber ha elaborado el informe 'La regulación y finaciación de los medicamentos biosimilares en la OCDE', un trabajo para el que ha contado con la financiación de Biosim, la asociación española de empresas titulares de estos productos, y en el que se pone de manifiesto que la inclusión de los biológicos similares en el sistema de precios de referencia nacional es una práctica habitual de los países de nuestro entorno.
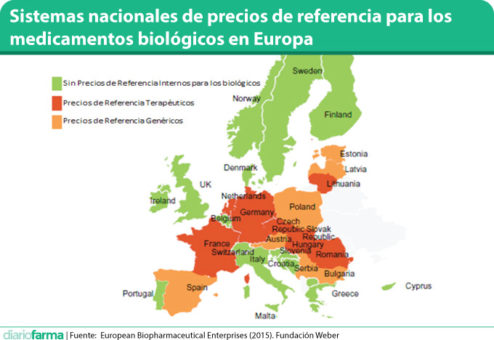
Concretamente, la mitad de los países europeos (15 de 31) estarían incluyendo biológicos y biosimilares en sus sistemas de precios de referencia internos, aunque hay diferencias, ya que, mientras Francia o Alemania aplican los sistemas de referencia terapéutica (compara entre grupos terapéuticos ATC 4), otros, como España utilizan el sistema de precios de referencia empleado para los genéricos (compara por sustancia activa o ATC 5). Entre los países que no aplican el SPR interno a esta gama de productos destacan algunos como Reino Unido, Dinamarca o Portugal.
En el caso concreto de este último, el precio de los biosimilares se fija, según el informe, tomando como referencia los precios promedio de otros tres países europeos (España, Francia y Eslovaquia), siguiendo el mismo esquema de reembolso que los biológicos de referencia, es decir, mediante acuerdos de entrada adaptados al precio y la cuota de mercado de ambos medicamentos. No obstante, una reforma implementada en 2015 propició que el precio del biosimilar deba situarse, al menos, un 20% por debajo del precio del biológico de referencia (frente al 30% que se aplica a los genéricos), y se somete a revisiones anuales. En Reino Unido son tratados como genéricos complejos de marca, y su precio debe ser acordado con el Ministerio de Sanidad, mientras que en Dinamarca el precio de los biosimilares es establecido libremente por sus fabricantes, si bien posteriormente los reguladores les aplican descuentos sin que haya ninguna regla especial, lo que no impide que este país consiga las mayores rebajas en casos como el de infliximab o filgrastim.
Teniendo en cuenta los diferentes sistemas que se aplican para la fijación del precio y reembolso, los autores del estudio estiman que en Europa los biosimilares se están financiando a unos precios promedio entre un 25% y un 30% por debajo de los productos de referencia, aunque pueden llegar al 50% o más en algunos casos, en contraste con la reducción de precio del 80% que alcanzan los genéricos frente a sus comparadores. En muchos casos, recuerdan, también se les aplican descuentos sobre las compras, que en países como Dinamarca pueden llegar hasta el 70%. También se refieren a la bajada general de precios en el común de los tratamientos por la mera entrada de los biosimilares y la competencia que generan, la cual oscila entre el 8% y el 81%.
Los autores del informe también se han fijado en la fórmula de adquisición de los biosimilares, la cual, dicen, difieren entre países. No obstante, prosiguen, en la mayoría de ellos se compran los biológicos acceden a través de concursos públicos, los cuales, en países como España, Francia o Italia, se realizan a nivel hospitalario, mientras que en Reino Unido y Dinamarca se realizan tanto a nivel hospitalario como extra-hospitalario y en Alemania se articulan a través de licitaciones públicas y contratos privados con hospitales. "La evidencia sugiere que basar la compra de biosimilares en concursos públicos podría, en función del número de participantes, reducir precios y generar ahorros, aunque también podría suponer una barrera que desincentive la entrada al mercado, especialmente si en el concurso el ganador se lo lleva todo, corriéndose además el riesgo de un posible desabastecimiento del mercado", concluyen.
Sobre la sustitución y la intercambiabilidad
Junto a estos aspectos relacionados con la financiación, el documento recoge una mención expresa a las diferentes políticas que siguen los países en lo que respecta a la intercambiabilidad y la sustitución de los biológicos por biosimilares, un aspecto que, recuerdan, queda dentro del ámbito competencial nacional. "En la mayor parte de los países desarrollados, la intercambiabilidad suele estar permitida, aunque debe realizarse bajo la responsabilidad del facultativo tratante o siguiendo la política establecida en el centro asistencial, y siempre procurando mantener la trazabilidad. En países como Italia, Dinamarca o Portugal, el cambio del biológico de referencia por el biosimilar está incluso recomendada para pacientes que comienzan el tratamiento", explican.
En lo que respecta a la sustitución, los autores afirman que en la UE "priman los países que prohíben explícitamente la sustitución de biológicos originales por biosimilares por parte de los farmacéuticos (20 de los 31 países cuentan con leyes o normas que así lo establecen), y citan a países como Reino Unido, Alemania, Italia y España, con normas que impiden la sustitución a nivel farmacéutico. "Sin embargo", prosiguen, "otros como Francia han sido más laxos, identificando a los pacientes naive que inician el tratamiento como una población adecuada para realizar una potencial sustitución, mientras que Portugal carece de una regulación específica al respecto". En el otro extremo aparecen Estonia y Polonia, donde actualmente se permite la sustitución efectiva de biosimilares por parte del personal de los Servicios de Farmacia farmacéutico.
No obstante, el informe recoge los resultados del famoso ensayo clínico aleatorizado NOR-SWITCH, el cual fue patrocinado por el Gobierno noruego. En él participaron casi 500 pacientes sometidos a un tratamiento estable con infliximab durante al menos seis meses para, posteriormente, cambiar a la mitad de ellos al biosimilar de infliximab. "Los datos revelan que la eficacia y la seguridad fueron comparables en este grupo y en aquellos que permanecieron en el del medicamento principal", concluyen.
Fuera de Europa, Japón y Australia no permiten la sustitución automática de biosimilares, mientras que en EEUU existe una alta variabilidad entre los estados que conforman el país, con muchos de ellos que sí lo permiten, a no ser que el clínico especifique lo contrario.
Medidas para promover el uso de los biosimilares
Por último, y en la línea con las competencias de las que gozan los Estados miembro para impulsar el uso de biosimilares, los autores hacen referencia en su estudio a algunas medidas adoptadas, tanto nacional como regional, cuyo objetivo, dicen, "suele ser ampliar el ámbito de acceso de los pacientes, proteger a la industria o reducir los costes del sistema". Para ello, las iniciativas se diferencian entre sí por ser colaborativas o coercitivas. "Entre
las primeras se encuentran las políticas dirigidas a mejorar la formación e información de los agentes, especialmente los clínicos, la creación de incentivos para aumentar la prescripción a través de guías clínicas o la fijación de cuotas", explican. Y añaden: "Entre las medidas coercitivas se encuentran algunas como multas o sanciones por no cumplir los objetivos de prescripción fijados".
En lo que respecta a la fijación de cuotas, consideran que es una fórmula en auge, y señalan a Alemania, que cuenta con cuotas variables entre regiones, que oscilan entre el 10% y el 50%, o Portugal, que ha fijado recientemente una cuota mínima del 20% para cada uno de los hospitales públicos del país. También hay regiones italianas, donde el 50% de los ahorros generados gracias a los biosimilares se destinan a aumentar el presupuesto para medicamentos innovadores, y otras alemanas, donde se aplican sanciones por la diferencia entre el presupuesto fijado y el real.















 :
:  Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados:
Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados:  Margarita de la Pisa, eurodiputada de Vox.:
Margarita de la Pisa, eurodiputada de Vox.:  Ion Arocena, director general de la Asociación Española de Bioempresas (Asebio):
Ion Arocena, director general de la Asociación Española de Bioempresas (Asebio):  Javier Padilla, secretario de Estado de Sanidad:
Javier Padilla, secretario de Estado de Sanidad: