IQVIA Institute for Human Health Data Science ha publicado un informe titulado '2018 and Beyond:
Outlook and Turning Points', en el que analiza los principales aspectos que van a caracterizar, según sus previsiones, el mercado farmacéutico mundial en los próximos cinco años. En este periodo, advierten, por un lado, la emergencia de nuevas terapias (génicas y celulares, principalmente), asociadas a un alto coste, así como innovaciones en especialidades como el cáncer o las enfermedades raras, vinculadas también a precios elevados, y, por otro, un impacto negativo sobre el gasto por la pérdida de exclusividad de un buen número de moléculas, muchas de ellas biológicas, así como una mayor tendencia de los pagadores a remunerar por resultados, ganando eficiencia en el gasto realizado.
En lo que respecta a las terapias génicas y celulares, de las que se esperan entre 5 y 8 lanzamientos sólo en 2018 (entre 40 y 50 hasta 2022), destacan que suelen estar asociadas a un "alto grado de incertidumbre y a un coste elevado, con el consiguiente aumento de la presión presupuestaria". Y es que, explican, "la incertidumbre con respecto al acceso y las dudas sobre el retorno de la inversión hace que los fabricantes se esfuercen por conseguir precios tan elevados como el mercado pueda aceptar", precios que superarán, casi siempre, "los 100.000 dólares por paciente".
Según los autores del documento, "es costes pueden generar preocupación en los pagadores, que finalmente se pueden ver empujados a restringir el acceso". Finalmente, opinan que esta "nueva generación de medicamentos no va a ser accesible si no se acotan bien los pacientes elegibles y se negocian pagos basados en resultados u otras fórmulas que permitan la amortización de los costes a medio plazo". "El reto para laboratorios y pagadores será el diseño de nuevos esquemas de fijación de precio y reembolso para poder maximizar el acceso a estas terapias, teniendo en cuenta que algunas de ellas serán curativas, lo que implica que no van a suponer un flujo de ingresos constante para las compañías farmacéuticas y eso elevará su precio", concluyen.
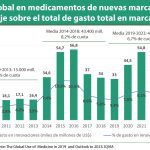
Además del impacto que puede suponer esta nueva generación de terapias, prevén que serán los medicamentos de especialidad los que seguirán tirando del gasto en los próximos años. En este sentido, estiman que este llegará a situarse en el 48% del gasto total en los 10 principales mercados (Estados Unidos, Japón, Canadá, Australia, Corea del Sur, Reino Unido, Alemania, Francia, Italia y España), siendo la Oncología, las enfermedades autoinmunes, así como los medicamentos biológicos los máximos exponentes de ese incremento, además de las enfermedades raras. En este caso, avanzan su impresión de que los pagadores continuarán con "la tendencia será a limitar el acceso, así como la aplicación de esquemas basados en el pago por valor".
No obstante, recuerdan que estos esquemas llevan aparejados sus propios retos para laboratorios (los cuales están cada vez más interesados en su aplicación cuando tienen competidores de los que quieren diferenciars), por lo que su éxito va a estar condicionado por "el uso de datos fáciles de registrar y que puedan ser validados de forma independiente", entre otros aspectos. Si no se consigue, existe riesgo de que la carga administrativa termine por quitarles el atractivo para los distintos agentes.
La entrada de genéricos y biosimilares
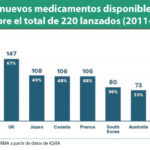
Además de la aplicación de estos esquemas, hay otras herramientas que a buen seguro que van a contribuir el gasto bajo control, un gasto que, en todo caso, no es tan elevado como se pinta. Y es que señalan que la diferencia entre el gasto real en medicamentos de marca (unos 395.000 millones de dólares en 2017) es muy diferente del oficial (unos 541.000 millones), ya que a estas cifras habría que restarles los descuentos que consiguen los pagadores. Sobre las herramientas citadas, habría que destacar el impacto que se le prevé a la pérdida de patentes, tanto en moléculas químicas como en biológicas, impacto que podría ser un 37% superior al registrado en el quinquenio anterior. La reducción del gasto por este motivo será de 30.000 millones en todos los países desarrollados sólo en 2020, año en el que se marcará el pico. Por el contrario, el impacto de las nuevas moléculas que se lanzarán al mercado, entre 40 y 45, rondará el 2,5%-3,5% anual, con un acumulado del 15% para todo el quinquenio.
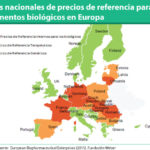
Sólo en 2018, se espera que un número determinado de biológicos, asociados a un gasto de 19.000 millones de dólares, se exponga a la competencia de nuevos biosimilares, que se sumarán a los 26.000 millones que representaba ese mercado en 2017. Además, de 2019 a 2022 se abrirá el campo para un mercado adicional de unos 52.000 millones, lo que hará que, al final de dicho periodo el 77% del mercado de biológicos ya esté sujeto a dicha competencia. "Esto sólo se podrá ver frenado por la capacidad de desarrollo de las compañías que tienen ya los biosimilares en pipeline o por litigios abiertos por laboratorios propietarios del medicamento de marca", explican.
No obstante, existe, dicen, "un riesgo para el mantenimiento de esta competición si no se diseñan incentivos suficientes para animar a los laboratorios de biosimilares". Y es que, añaden, "existe la duda de si todos los biológicos que se enfrentan a final de patente van a ser retados y por cuantas compañías, ya que hay algunos con más de 10 años en el mercado para los que aún no se conoce proyecto de desarrollo de un biosimilar que vaya a competir con él en los próximos 10". En este sentido, recuerdan que en este mercado hay grandes compañías, como Pfizer, Novartis, Amgen o MSD, así como otras más pequeñas, y piensan "que el mercado que se le espera a esas moléculas podría ser demasiado pequeño para atraer su interés, teniendo en cuenta las complejidades de producción". "Sólo el tiempo nos confirmará el ahorro real que van a generar los biosimilares", concluyen.
Sin embargo, con todo lo dicho, prevén que el gasto se va a mantener controlado en la mayoría de los países desarrollados (acaso podría darse un ligero repunte en Estados Unidos), lo que "proporcionará a los pagadores la oportunidad de atender a otras cuestiones como las inequidades, la mejora del acceso o la inversión en actuaciones que ayuden a limar las ineficiencias".
La emergencia del 'Real World Evidence'
Además de estas cuestiones, el informe recoge las intenciones de la FDA de desarrollar, en este 2018, el primer marco regulatorio para acelerar la aprobación de fármacos sobre la base del Real World Evidence, algo que, anticipan, "podría tener un impacto significativo en el diseño de los ensayos". A este respecto, destacan la intención de la FDA de aceptar el uso de RWD para aprobaciones iniciales de moléculas que vienen a cubrir lagunas terapéuticas, de lo cual ya se ha sentado un precedente con la aprobación de avelumab (Bavencio) para el carcinoma de células Merkel metastásico, para la que se evaluaron datos de vida real de los comparadores para describir el curso natural de la enfermedad.
"Un uso rutinario del RWE para hacer la comparación en ensayos clínicos podría ofrecer la posibilidad de reducir la necesidad de disponer de grupos control, permitiendo la reducción de costes en I+D y multiplicando el número de moléculas que pueden ser desarrolladas y lanzadas con el mismo gasto y de una forma más ágil", concluyen. Si eso puede repercutir en la reducción del precio de los medicamentos está por ver.














 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: