El Ministerio de Sanidad sigue actualizando el formato en el que presenta las notas informativas de las reuniones de la Comisión Interministerial de Precios de los Medicamentos (CIPM). Si hace unos meses empezó a incorporar el precio notificado de los medicamentos autorizados, en la última nota informativa, correspondiente a la reunión 190 de la comisión, celebrada el pasado 25 de abril, han incorporado los criterios del artículo 92 del Real Decreto legislativo 1/2015, por el que se aprueba el Texto refundido de la Ley de Garantías en los que se basa cada decisión.
De este modo, Sanidad empieza a incorporar a la información de las notas de la CIPM algunos datos más referidos a la financiación de medicamentos y, en concreto, los criterios que la justifican como selectiva y no indiscriminada. Otros datos que podrían aparecer de aquí en adelante y que completarían la información aportada podrían ser, entre otras, las reservas establecidas a la prescripción, dispensación y financiación.
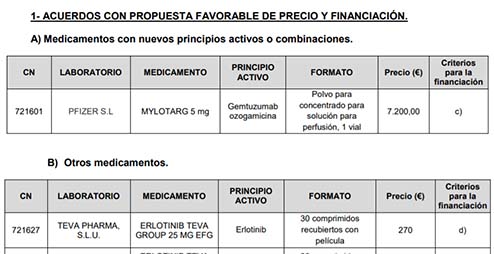
De los medicamentos incorporados a la cartera común el valor terapéutico y social del medicamento y beneficio clínico incremental del mismo teniendo en cuenta su relación coste-efectividad (apartado c del artículo 92 del RDl 1/2015) es el utilizado tanto para nuevos productos como nuevas indicaciones. Solo se han aprobado algunos medicamentos con la justificación de la Racionalización del gasto público destinado a prestación farmacéutica e impacto presupuestario en el Sistema Nacional de Salud (apartado d del artículo 92) para una serie de presentaciones de un medicamento genérico, erlotinib de Teva.
Precisamente estas mismas razones esgrimidas para la aprobación de medicamentos han sido las que han justificado la decisión contraria en otros muchos casos. Solo se ha utilizado el apartado e (existencia de medicamentos u otras alternativas terapéuticas para las mismas afecciones a menor precio o inferior coste de tratamiento) para el caso de cuatro presentaciones de Mylan y Adamed para dos genéricos que tendrían un coste superior al de otros medicamentos ya comercializados.
Medicamentos incluidos en la prestación
Más allá de los criterios de la financiación o su rechazo esgrimidos por la CIPM, cabe destacar que se ha autorizado la primera presentación de Mylotarg (gemtuzumab ozogamicina) de Pfizer, así como nuevas indicaciones de Tagrisso (osimertinib) de AstraZeneca. Igualmente se han autorizado varios medicamentos que se encontraban en trámite de alegaciones, como Besponsa (inotuzumab ozogamicina) de Pfizer o Latuda (lurasidona) de ACRAF SPA.
Por el contrario, los acuerdos con propuesta desfavorable de financiación y fijación de precio han afectado a medicamentos como Zalmoxis (Linfocitos T alogénicos modificados genéticamente para expresar el gen suicida TK) de Dompe; Blincyto (blinatumomab) de Amgen; Translarna (atalureno) de PTC Therapeutics
Igualmente, la CIPM ha rechazado la comercialización de dos anillos vaginales con progestágeno y estrógeno de Mylan y Adamed, así como cuatro presentaciones de Prevymis (letermovir) de MSD.





















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: 