“El Informe de Posicionamiento Terapéutico (IPT) tiene que constituirse como una herramienta que, en el ámbito de la toma de decisiones, se considere de referencia en cualquiera de los puntos donde se realiza evaluación de medicamentos”. Así ha definido la directora general de Cartera Común de Servicios del SNS y Farmacia, Patricia Lacruz, el objetivo general que persiguen con la redefinición de los IPT que se ha plasmado en el “Plan para la consolidación de los informes de posicionamiento terapéutico de los medicamentos en el Sistema Nacional de Salud” que ha sido presentado telemáticamente este jueves.
Según Lacruz, el Plan define la metodología y los medios necesarios para conseguir que los IPT “lleguen a tener legitimidad de forma completa para ser la herramienta de evaluación de medicamentos en el SNS”. Para conseguirlo, el Plan ha abordado una serie de líneas de trabajo que van desde la configuración y creación de la Red Revalmed SNS, al establecimiento de una metodología para la elaboración y la aprobación de los IPT y, por último, el desarrollo de un cuadro de mando que permita el control y seguimiento de los IPT. De este modo, Lacruz espera que “la calidad del documento” cumpla con las expectativas ya que esa es la manera de convertirlo “en referencia para la evaluación de medicamentos, sin menoscabo de la evidencia”.
Revalmed
La clave de los nuevos IPT se encuentra en la configuración de un trabajo en red que se coordina desde la Dirección General de Cartera Común, la Agencia Española de Medicamentos (Aemps) y las propias comunidades autónomas a través de lo que se ha denominado Revalmed. Una entidad que estará dirigida, tal y como ha dicho Lacruz por la “co-gobernanza y tejida por las alianzas entre Ministerio, y las CCAA” a través de la Comisión Permanente de Farmacia.
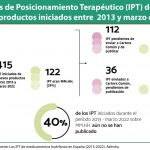
La configuración de la red está distribuida, inicialmente, en siete nodos de evaluación correspondientes a diferentes ámbitos clínicos (enfermedades inmunomediadas; enfermedades raras no oncológicas y terapias avanzadas; antiinfecciosos; oncología; hematología oncológica; sistema nervioso central y un último más diverso dirigido a patología cardiovascular, factores de riesgo cardiovascular, hematología no oncológica y respiratorio). En un principio formarán parte de estos nodos un total de 114 profesionales de 14 especialidades diferentes designados por las comunidades autónomas. Cada nodo tendrá un coordinador y un co-coordinador. Además, habrá dos equipos de evaluación, uno para la terapéutica que estará liderado por la Aemps y otro de evaluación farmacoeconómica, liderado por la dirección general de Lacruz. En ambos participarán también las comunidades autónomas.

Por encima de esta estructura se situaría el grupo coordinador que tendría unas competencias similares a las del Grupo de Coordinación del Posicionamiento Terapéutico (CGPT) del anterior modelo, con excepción de la priorización de los IPT a realizar, cuya responsabilidad recaerá directamente en la Comisión Permanente de Farmacia y se realizarán en base a un checklist que permite puntuar diferentes aspectos como el lugar en la terapéutica, la existencia de alternativas financiadas o el beneficio clínico entre otros para alcanzar un valor que permita ordenar las prioridades de Revalmed.
Procedimiento de trabajo
En lo que se refiere al procedimiento de trabajo cabe señalar que, tras la decisión de elaborar el IPT, los borradores de los informes serán realizados por los equipos de evaluación terapéutica y los de evaluación farmacoeconómica. Este último se realizará siguiendo la metodología Rand-Ucla, que es la utilizada en la realización de los informes Génesis de la Sociedad Española de Farmacia Hospitalaria (SEFH). El borrador obtenido se someterá a valoración por el nodo de evaluación que corresponda y posteriormente por el grupo de coordinación. En este momento se producirá la fase de audiencia a los agentes interesados (compañía farmacéutica, sociedades científicas, asociaciones de pacientes).

Tras la valoración de las aportaciones realizadas se aprobará una primera versión del IPT que será publicada y será previa a la fijación de precio. Una vez que la Comisión Interministerial de Precios de los Medicamentos (CIPM) tome una decisión al respecto de la financiación y precio del medicamento se revisará y se publicará una versión final del IPT fase 3.
Todo este proceso se debería llevar a cabo en un periodo de entre 90-95 días hábiles a los que habrá que añadir los tiempos entre convocatorias de los distintos grupos, en especial del de coordinación, cuya periodicidad de reunión se estima en mensual y debe tomar partido al menos en tres ocasiones a lo largo del proceso de elaboración de cada IPT.
Por último, el cuadro de mando permitirá conocer la situación en la que se encuentra cada IPT, así como el grado de cumplimiento de los plazos establecidos en cada fase. Además, se informará a cada compañía del momento en que se inicia el procedimiento en un medicamento de su responsabilidad.

Cambios introducidos
Según explicó Lacruz, los principales cambios introducidos en los IPT consistirán en incluir la información de la evaluación farmacoeconómica; estructurar la información descriptiva con las alternativas terapéuticas disponibles y sus resultados; estructurar la información de manera que guíe la lectura crítica de la evidencia; estructurar la información sobre valoración del beneficio clínico incremental del medicamento; así como estructurar la identificación de grupos y subgrupos con mejores resultados.
La directora general explicó que en este momento se está en periodos de pilotaje de los diversos procedimientos y que se procederá a realizar un IPT piloto por cada uno de los nodos, Mientras tanto, los IPT en marcha seguirán con los procedimientos actuales por lo que durante un tiempo convivirán ambas metodologías.
Agilización de las decisiones de precio y reembolso
Lo que no cambiará con la nueva metodología de elaboración de los IPT es la obligación de que estos estén finalizados para que un expediente sea llevado a la CIPM. No obstante, Lacruz explicó que trabajan con la “hipótesis” de que la evaluación económica previa y la participación de la red en las distintas fases “agilice el posterior expediente a la toma de decisiones de financiación y precio”. De cumplirse esta hipótesis, se daría cumplimiento a uno de los objetivos iniciales de los IPT, que era acelerar el acceso al mercado de los medicamentos.
Cabe destacar que la presentación del Plan se ha tenido que realizar en abierto a través de la página web del Ministerio de Sanidad con emisión por Youtube a consecuencia de la importante demanda que ha habido para asistir a la presentación. Además, en el chat habilitado para la realización de preguntas, se han superado las 70 peticiones, de las que la directora general ha respondido en directo a un número importante, aunque han quedado numerosas cuestiones sin respuesta por falta de tiempo. A este respecto, Lacruz ha explicado que se elaborará un documento de preguntas y respuestas, para explicar más a fondo algunas de las características del Plan y que el documento en sí será publicado en la web del Ministerio a lo largo de este viernes.


















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: 