Artículo de opinión de Ana Mozetic, Socia responsable de la división Healthcare en España Simon-Kucher y Laura Sánchez-Calero, Senior Manager en Simon-Kucher

En septiembre de 2022, a través de Diariofarma, desde Simon-Kucher publicábamos un artículo sobre las tendencias en financiación de medicamentos observadas en España entre enero de 2019 y diciembre de 2021. A lo largo de estos últimos meses, hemos analizado las resoluciones de financiación publicadas en las notas informativas de la Comisión Interministerial de Precios de Medicamentos (CIPM), desde Febrero (Acuerdos CIPM 221) hasta Diciembre (Acuerdos CIPM 230) de 2022, para entender cómo han variado estas tendencias en los últimos 12 meses. ¿Qué porcentaje de medicamentos alcanzó un acuerdo positivo en la primera reunión con la CIPM y qué implicaciones tuvo en sus condiciones de precio y acceso? ¿Cuál es el tiempo medio requerido para alcanzar un acuerdo positivo de financiación? ¿Está afectando a estas decisiones el cambio en la metodología de los Informes de Posicionamiento Terapéutico (IPT)?
En las 10 reuniones que se han llevado a cabo a lo largo del año 2022, se han adoptado 251 acuerdos de financiación, tanto positivos como denegatorios, incrementándose en un 35% el número total de acuerdos establecidos con respecto a 2021 (186 acuerdos). Al igual que en el artículo previamente publicado, se han incluido en el estudio medicamentos con nuevos principios activos o combinaciones, y nuevas indicaciones de medicamentos que ya estaban incluidos en la prestación farmacéutica del Sistema Nacional de Salud (SNS)1. Se han excluido los acuerdos referentes a las alteraciones en la oferta, así como acuerdos aplicados a vacunas, medicamentos genéricos / biosimilares y dispositivos médicos2.
Si bien el resultado es un mayor número de acuerdos positivos de precio y financiación en este último año, un 39% más que en 2021, la proporción de acuerdos positivos frente a acuerdos denegatorios que se observaba en 2021 se ha mantenido en 2022. Durante este último año, únicamente el 45% (114) de los expedientes de financiación negociados con la Subdirección General de Farmacia (SGF), ha alcanzado un acuerdo de financiación positivo.
Aunque la proporción de acuerdos positivos de financiación frente al total de acuerdos se haya mantenido prácticamente constante entre ambos periodos de tiempo, se puede observar que un mayor porcentaje de nuevos fármacos ha recibido un acuerdo positivo de financiación en una primera reunión de la CIPM (19% en 2022 frente a 12% en 2021), y que el porcentaje de nuevas indicaciones que ha obtenido un acuerdo positivo de financiación en la primera reunión de la comisión, se ha reducido con respecto al 2021 (9% frente a 15%).

Además, desde Simon-Kucher, estamos analizando separadamente el impacto que la evaluación económica reflejada en los informes de posicionamiento terapéutico (IPTs) podría estar teniendo en estas decisiones (positivas o denegatorias) de financiación. En el último año, se publicaron 13 IPTs con la metodología REvalMed, aunque la alusión a la evaluación económica de los mismos en las notas de la CIPM es todavía muy limitada, mencionándose únicamente en dos de las decisiones publicadas este último año (ambas denegatorias).
En cuanto al tiempo requerido para alcanzar un acuerdo positivo de financiación, el obtener una decisión denegatoria durante la primera reunión de la CIPM supuso un retraso medio en la financiación de cuatro meses con respecto a aquellos fármacos que obtuvieron una decisión positiva en la primera reunión, tanto para nuevos medicamentos como para nuevas indicaciones. Tras una primera denegación, el periodo más corto para la aprobación fue de aproximadamente dos meses (56 días) y el más largo de 24 meses (707 días), en línea con lo observado en 2021 (con un mínimo de 64 días y un máximo de 749).
Centrándonos ahora únicamente en los acuerdos de financiación positivos, este análisis busca de nuevo entender las tendencias en condiciones especiales de financiación implementadas a lo largo del año 2022 y como difieren con respecto a las tendencias observadas en el análisis anterior (2019-2021).
De forma general, las condiciones especiales de financiación se pueden agrupar en tres categorías: (1) Condiciones relacionadas con medidas del control del gasto, (2) Condiciones que implican una restricción en la indicación o acceso al tratamiento y (3) Acuerdos especiales de financiación.
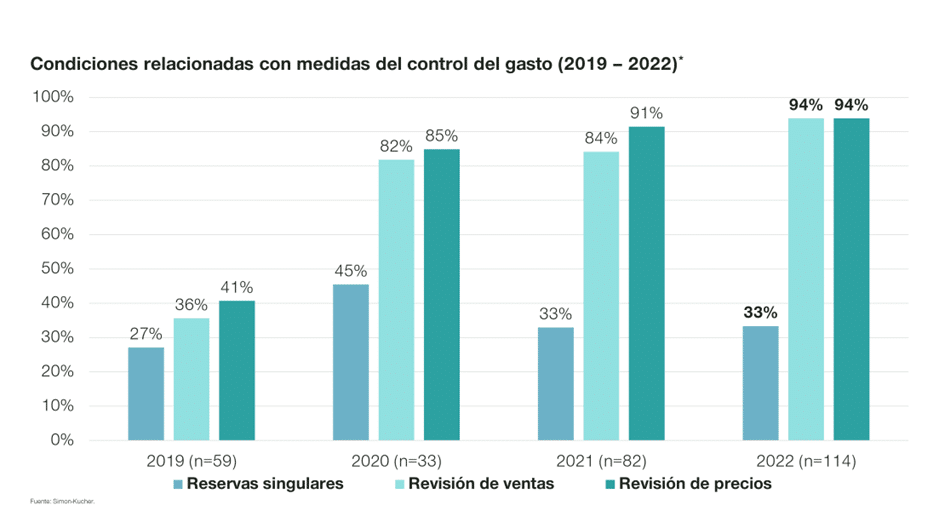
1. Condiciones relacionadas con medidas del control del gasto:
La racionalización del gasto público y el impacto presupuestario continúan siendo criterios clave en la financiación de un medicamento, por lo que las medidas del control del gasto son ampliamente utilizadas. Tanto es así, que el 100% de los acuerdos positivos han llevado asociada alguna de ellas en 2022. Entre ellas, las más comunes son la “revisión anual de las ventas y de los precios ahora fijados”, que aplican al 94% (107) de los acuerdos positivos en el último año.
2. Condiciones que implican una restricción en la indicación o acceso al tratamiento
La implementación de restricciones de financiación con respecto a la indicación aprobada por la Agencia Europea del Medicamento (EMA), continúa siendo frecuente en 2022. Tanto es así, que en un 42% (38) de los acuerdos de 2022 para productos hospitalarios o dispensados en farmacia hospitalaria, la financiación está sujeta a este tipo de condición. Asimismo, en el 30% (7) de los acuerdos referentes a medicamentos dispensados en farmacia comunitaria, se estableció un visado de inspección que incluía restricciones adicionales en el acceso de cinco de ellos y establecía condiciones especiales de seguimiento para los otros dos.
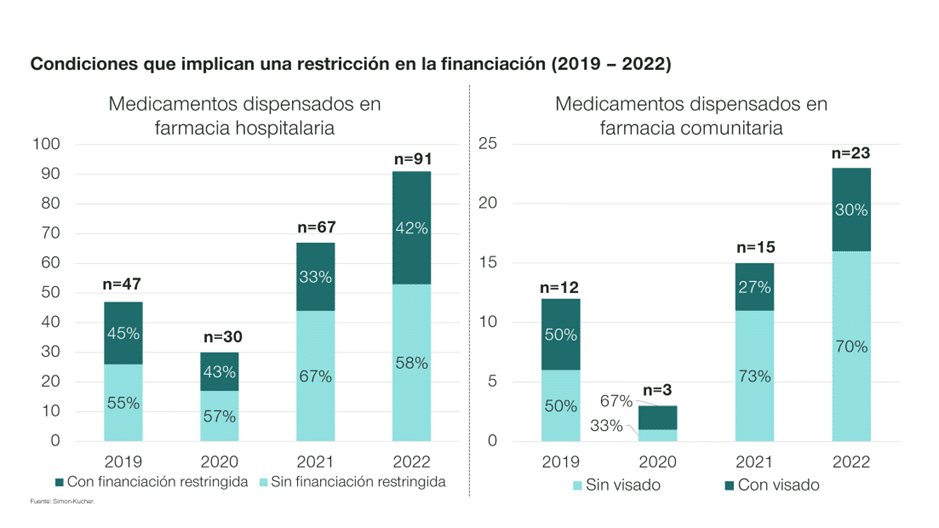
Cabe destacar en este punto, que durante el año 2022 y para la muestra evaluada3, más de un 80% de los acuerdos positivos (91) fueron sobre fármacos hospitalarios o dispensados en farmacia hospitalaria, en línea con 2021, donde este porcentaje fue del 82% (67).
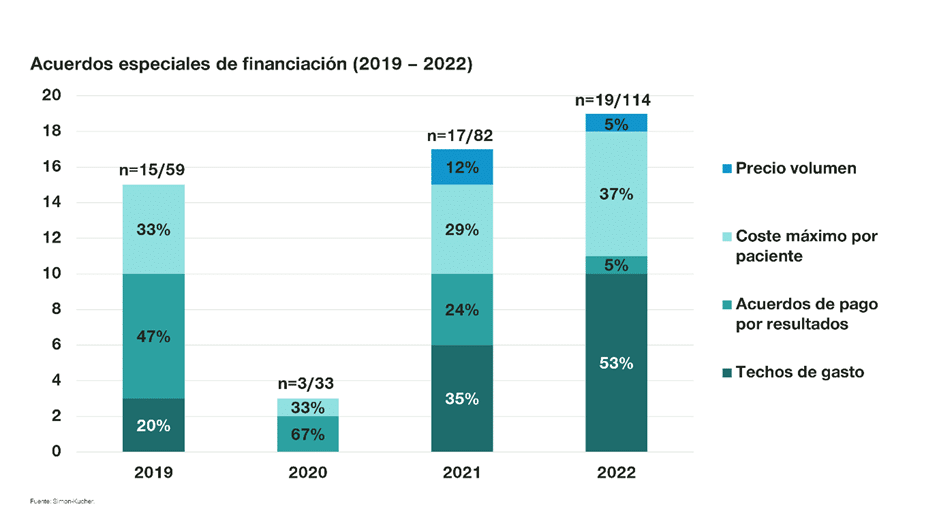
3. Acuerdos especiales de financiación
De los acuerdos positivos de financiación analizados en 2022 (114), un 17% (19) está sujeto a algún tipo de acuerdo especial de financiación. Se aprecia una manifiesta inclinación por aquellos acuerdos puramente financieros en detrimento de los acuerdos basados en resultados clínicos. Así, en el periodo analizado se han establecido diez techos de gasto (9%), siete (6%) acuerdos de coste máximo por paciente y un acuerdo de precio / volumen, frente a un único acuerdo de pago por resultados.
Entonces, ¿cómo han evolucionado las tendencias en financiación de medicamentos en España durante el año 2022?
- Se observa que el Ministerio de Sanidad sigue fomentando la evaluación e inclusión de nuevos fármacos en la cartera de servicios del SNS, incrementándose de 186 decisiones (82 acuerdos positivos de financiación) en 2021 hasta las 251 decisiones (114 acuerdos positivos de financiación) del pasado 20223.
- Durante este último periodo, se aprecia de nuevo que un notable porcentaje de las decisiones de financiación positivas se toman tras un proceso de alegaciones. Así, el 17% de todos los acuerdos se adoptaron en reuniones sucesivas de la CIPM, misma cifra que en 2021.
- En base a los datos del análisis de 2022, se puede concluir que la implementación de medidas de control del gasto asociadas a los acuerdos de precio y financiación es ya un proceso sine qua non, y es que ninguno de los acuerdos de financiación positivos ha conseguido serlo sin la aplicación de alguna de estas medidas.
- Se ha observado un ligero incremento en el porcentaje de financiaciones con restricciones en el acceso observado en los productos de ámbito hospitalario o dispensados en farmacia hospitalaria, 41% en 2022 frente a 33% en 2021.
- En cuanto a los acuerdos relacionados con medicamentos dispensados en farmacia comunitaria, el ligero incremento observado en los visados de inspección aplicados, podría indicar un mejor funcionamiento de los sistemas informáticos y la consecuente reducción de la carga administrativa asociada, o bien un mayor control del gasto a nivel farmacia comunitaria.
- En cuanto al desarrollo de acuerdos especiales de financiación, en línea con lo que observábamos durante el anterior periodo analizado, vemos que siguen siendo una herramienta recurrente para medicamentos de alto impacto presupuestario. Además, la preferencia por los acuerdos puramente financieros sobre los basados en resultados clínicos se ha podido confirmar durante el 2022.
- Si bien el número de IPTs desarrollados con la metodología REvalMED es cada vez mayor, el impacto de la evaluación económica incluida en ellos no es todavía concluyente en base a la muestra disponible. Desde Simon-Kucher, seguimos monitorizando el peso que este análisis económico tiene en los acuerdos de financiación.
- De acuerdo a este nuevo estudio, y como parte del proceso de preparación de la negociación de financiación de un medicamento, desde Simon-Kucher recomendamos que:
- Los laboratorios comercializadores evalúen los aspectos clave en torno al producto, entendiendo tanto las incertidumbres como las principales inquietudes que podría despertar en el Ministerio (ya sean clínicas y/o económicas) y preparen estrategias que permitan su mitigación.
- Además, debe definirse una ruta de negociación clara, con pasos y concesiones evaluados en profundidad, que permita al sistema asumir el coste de la innovación y que estén ligadas con el beneficio clínico ofrecido por el fármaco.
- Asimismo, para casos de alto coste o de impacto presupuestario considerable, es muy recomendable que el laboratorio se prepare para discutir diferentes escenarios a lo largo de la negociación, incluso proponiendo algún tipo de acuerdo especial de financiación que permita al Ministerio de Sanidad reducir la incertidumbre económica del fármaco.
Consideraciones para el análisis
(1) Acuerdos relativos a la inclusión o no inclusión en la prestación farmacéutica del Sistema Nacional de Salud (SNS) de medicamentos con nuevos principios activos o combinaciones (A.1) y de otros medicamentos (A.2). En lo referente al subapartado A.2; para este análisis sólo se han tenido en cuenta aquellos medicamentos que cambien sus condiciones de comercialización (por ejemplo, por pasar de estar no financiado a entrar en prestación o aquellas nuevas presentaciones que estén ligadas a una extensión de indicación). No se han contemplado primeros genéricos o biosimilares, se ha asumido que reciben las mismas condiciones de financiación que el medicamento original.
Acuerdos relativos a la inclusión o no inclusión en la prestación farmacéutica del SNS de nuevas indicaciones de medicamentos que ya están incluidos en la prestación farmacéutica del SNS.
(2) No se han estudiado las condiciones de financiación de aquellos medicamentos incluidos en el grupo "Alteraciones de la oferta". Es decir, a la modificación de las condiciones de financiación y precio (precio al alza o la baja, condiciones de la prescripción y dispensación, exclusión de la prestación) de medicamentos incluidos en la prestación farmacéutica del SNS. Las vacunas y dispositivos médicos tampoco han sido objeto de estudio.
(3) El número de decisiones refiere únicamente a aquellos medicamentos seleccionados como objeto de este estudio: medicamentos con nuevos principios activos o combinaciones y nuevas indicaciones de medicamentos que ya están incluidos en la prestación farmacéutica del SNS.
(4) Establecimiento de reservas singulares en el ámbito del Sistema Nacional de Salud, consistente en a) limitar su dispensación, sin necesidad de visado, a los pacientes no hospitalizados en los Servicios de Farmacia de los Hospitales, o b) la dispensación mediante visado restringido al tratamiento de pacientes determinados.
Ana Mozetic, Socia responsable de la división Healthcare en España Simon-Kucher; Laura Sánchez-Calero, Senior Manager en Simon-Kucher

 Artículo de opinión de Ana Mozetic y Laura Sánchez-Calero (Simon-Kucher), sobre los acuerdos que han resultado de las negociaciones de financiación y precio de los medicamentos en España en 2022.
Artículo de opinión de Ana Mozetic y Laura Sánchez-Calero (Simon-Kucher), sobre los acuerdos que han resultado de las negociaciones de financiación y precio de los medicamentos en España en 2022.














 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: 