La Agencia Española del Medicamento y Productos Sanitarios (Aemps) recibió la notificación de un total de 4.393 acontecimientos adversos durante el pasado año, de los cuales 43 afectaron a personas. Así lo recoge el Informe Anual sobre Farmacovigilancia Veterinaria del pasado año, publicado este martes por el regulador español.
La notificación o comunicación de un acontecimiento adverso (AA) a un medicamento veterinario se realiza tanto a través de la denominada Tarjeta Verde, como del sistema de notificación electrónica NotificaVET, de reciente creación por parte de la Aemps y dirigido a profesionales sanitarios y al público en general. En ese sistema existe también la opción para que el público en general notifique sospechas de AA con otro formulario más adaptado. Además, la aplicación de prescripción veterinaria del Consejo General de Colegios Veterinarios (PRESCRIVET) así como la del Consejo General de Colegios de Veterinarios de Andalucía (RECEVET), cuentan con un espacio de notificación de sospechas de acontecimientos adversos.
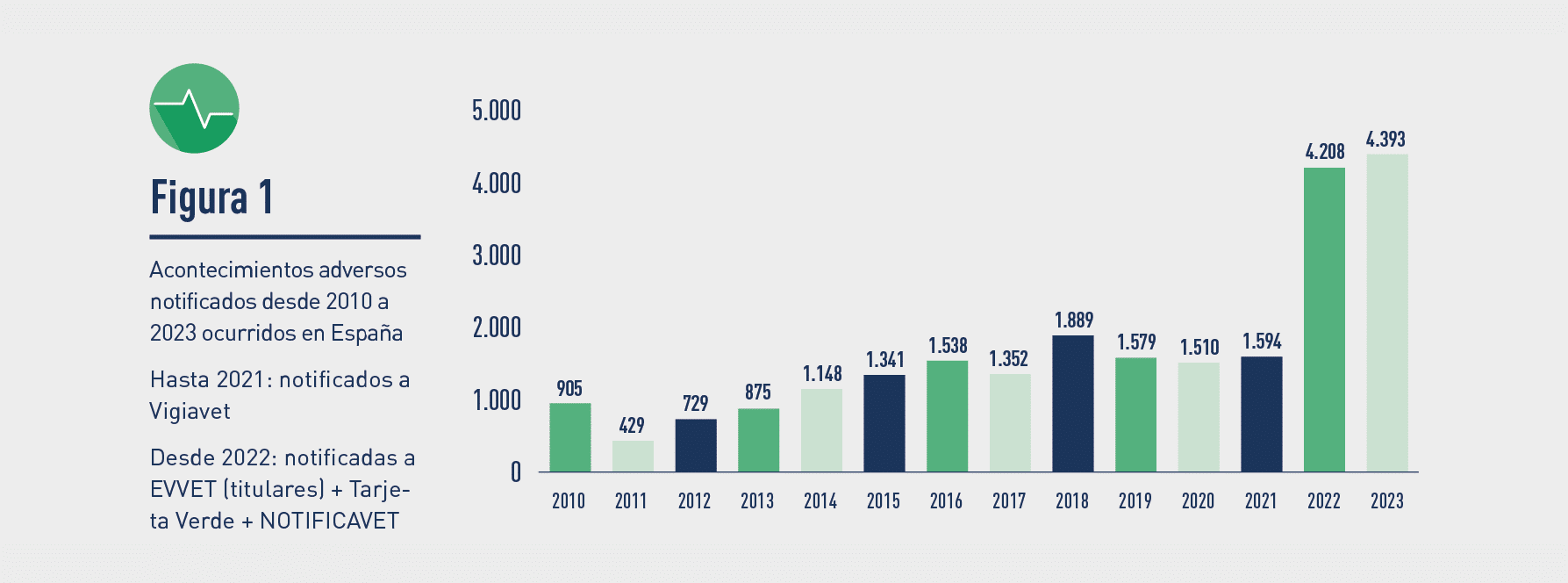
El incremento de casos registrados en 2023, con respecto a 2020 (1.5010 casos), 2021 (1.594) y 2022 (4.208) se debe, según explica la Aemps “al cambio de legislación, tras el cual los titulares tienen que notificar individualmente a EVVET todos los casos -graves y no graves-. Antes del 28 de enero de 2022 solo tenían obligación de notificar aquellas sospechas de acontecimientos adversos clasificadas en la anterior legislación como expeditivas, permitiéndose que las no expeditivas se acumulasen en los ‘line listing’ de los Informes Periódicos de Seguridad, donde no se podían realizar consultas y conocer exactamente los casos ocurridos en cada país de la UE”.
En cuanto a la estratificación de estos AA en 2023, las especies de destino en las que se presentaron fueron las siguientes: perro, gato, bovino, cerdo, ovino, conejo, caballo, caprino, hurones, peces y aves de corral. Menos de 5 casos ocurrieron en las siguientes especies: otras aves (gorrión, flamenco, quebrantahuesos), ratón (1), lobo (1), oso (1), abejas (1).

Con respecto a los medicamentos veterinarios implicados, los grupos en los que más frecuentemente se ha notificado corresponden a vacunas, ectoparasiticidas, medicamentos para el sistema nervioso, dermatológicos, endectocidas, hormonales y antimicrobianos.
Tras ellos, se encuentra medicamentos del sistema musculoesquéletico, antiparasitarios internos, sistema genitourinario, sistema digestivo, órganos sensoriales (ojo, oído), sistema cardiovascular y antineoplásicos. Otros con menos de 35 casos: sistema respiratorio (9) y sangre (4).
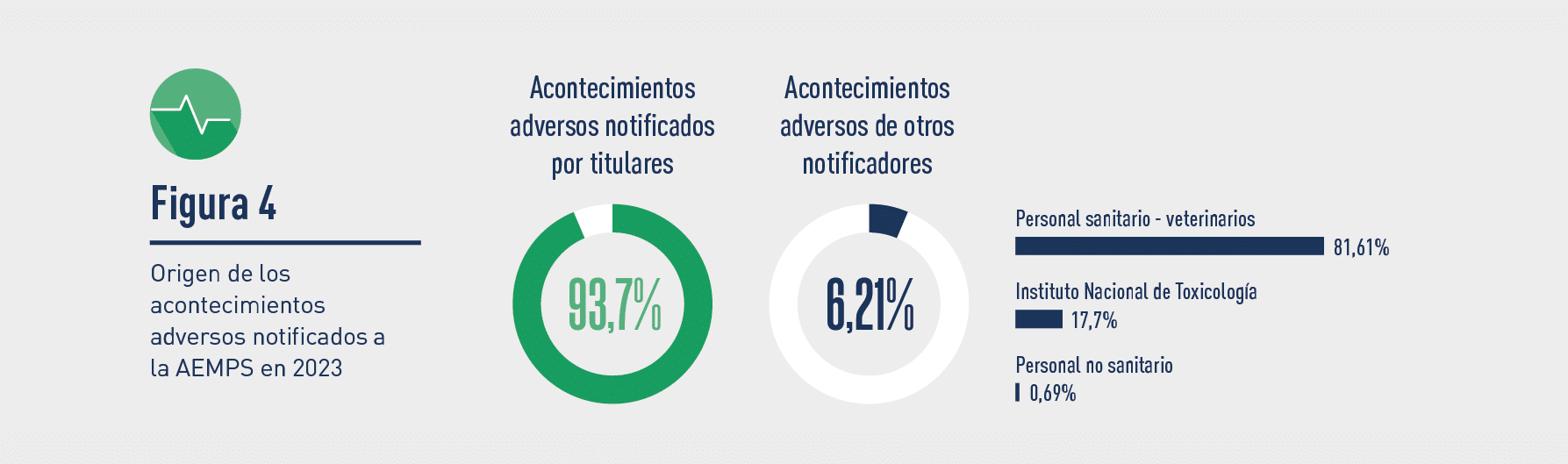
Respecto del origen de las notificaciones iniciales de casos ocurridos en España, en 2023 de nuevo fue mayoritaria la realizada por los titulares (4.120 AA, un 93,7 %) frente al resto de posibles orígenes (profesionales sanitarios, ganaderos, propietarios de animales, otros usuarios, etc.), que notificaron (273 AA) el 6,21 %. Entre los otros posibles orígenes (referido a las recibidas directamente en la Aemps), la gran mayoría fueron notificadas por veterinarios (81,61%), y en segundo lugar, por el Instituto Nacional de Toxicología.

Modificaciones de ficha técnica
En el año 2023, se recibieron 419 variaciones de ficha técnica, bien para adaptación de los textos a la nueva legislación (384 medicamentos) o cambios en los mismos por motivos de seguridad (36 medicamentos). Según explica la Aemps, “la legislación europea establece una serie de obligaciones en materia de farmacovigilancia para los titulares y entre ellas está la realización de una detección de señales para cada uno de sus medicamentos veterinarios al menos una vez al año. Tras ello, si se observara un cambio en la relación beneficio/riesgo en alguno de sus medicamentos, la legislación establece la remisión por parte de los titulares de una variación para modificar las condiciones de autorización del medicamento”.
Tras su evaluación y, en su caso, previo dictamen del Comité de Seguridad de Medicamentos Veterinarios (CSMV), en todos los medicamentos se concluyó que era necesario proceder a la modificación de los Resúmenes de Características, en el citado número de medicamentos.
En relación con el procedimiento de vigilancia y detección de señales de medicamentos veterinarios centralizados en EVVET /UPhD, en el año 2023 se realizaron 93 análisis, correspondientes a las revisiones para la detección de señales de los medicamentos veterinarios de los que España es ponente y/o responsable en el marco del P-SMEG (Pilot Signal Management Expert Group, grupo de trabajo de farmacovigilancia de la EMA).
Además de ello, se han realizado por este procedimiento un total de 144 Signal Detection ad hoc en diferentes grupos de medicamentos, y se continuó con un Targeted Signal Management iniciado el año anterior, sobre un grupo de medicamentos, cuyo estudio lidera España como responsable.















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: