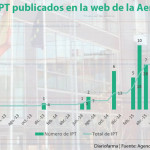
La Agencia Española de Medicamentos y Productos Sanitarios (Aemps) va a comenzar a trabajar en los informes de posicionamiento terapéutico (IPT) de los medicamentos que han obtenido una opinión positiva por procedimiento centralizado en la reunión del Comité de Medicamentos de Uso Humano (CHMP, por sus siglas en inglés) de la Agencia Europea de Medicamentos (EMA), celebrada en julio de 2025. Estos IPT corresponden tanto a los nuevos medicamentos (8) como a las nuevas indicaciones o modificaciones (3) de estas que han obtenido el visto bueno del comité.
En el caso de los nuevos medicamentos, el proceso de elaboración de los IPT comenzará en el momento en el que la AEemps reciba, por parte del titular de autorización de comercialización (TAC), la comunicación de la intención de comercializar estos medicamentos en España y la solicitud del código nacional.
Entre los nuevos medicamentos se encuentra Aqneursa (L-acetil-leucina), indicado para el tratamiento de las manifestaciones neurológicas de la enfermedad de Niemann-Pick de tipo C (NPC), en combinación con miglustat, o como monoterapia en pacientes que no toleran el miglustat, en adultos y niños a partir de 6 años y con un peso mínimo de 20 kg.
Otro de los nuevo fármacos es Ekterly (sebetralstat), de Ekterly de Kalvista Pharmaceuticals, para el tratamiento sintomático de los ataques agudos de angioedema hereditario (AEH) en adultos y adolescentes a partir de 12 años de edad.
También recibió visto bueno Romvimza (vimseltinib), de Deciphera Pharmaceuticals, indicado para el tratamiento de pacientes adultos con tumor tenosinovial de células gigantes (TGCT) sintomático, asociado a un deterioro clínicamente relevante de la función física y en quienes las opciones quirúrgicas se han agotado o provocarían una morbilidad o discapacidad inaceptables.
Otro de las fármacos a estudio es Tryngolza (olezarsen), de Ionis Ireland Limited como complemento de la dieta en pacientes adultos para el tratamiento del síndrome de quilomicronemia familiar (FCS) confirmado genéticamente.
Voranigo (vorasidenib), de Les Laboratoires Servier, en monoterapia está indicado para el tratamiento del astrocitoma u oligodendroglioma predominantemente no captante de Grado 2 con mutación en IDH1 R132 o IDH2 R172 en pacientes adultos y adolescentes a partir de 12 años de edad y que pesan al menos 40 kg, que sólo han sido sometidos a intervención quirúrgica y que no necesitan radioterapia o quimioterapia inmediatamente.
Otro de los fármacos sobre los que se elbaorara ITP es Yeytuo (lenacapavir), de Gilead Sciences el conocido inyectable indicado, en combinación con prácticas sexuales más seguras, para la profilaxis previa a la exposición (PrEP) con el fin de reducir el riesgo de infección por VIH-1 adquirida por vía sexual en adultos y adolescentes con mayor riesgo de adquisición del VIH-1, con un peso mínimo de 35 kg.
Los dos últimos medicamentos sobre los que comenzarán los trabajos de posicionamiento son Zurzuvae (zuranolona), de Biogen Netherlands B.V., para el tratamiento de la depresión posparto (DPP) en adultos después del parto y Kisunla (donanemab), de Eli Lilly Nederland para el tratamiento de pacientes adultos con un diagnóstico clínico de deterioro cognitivo leve y demencia leve debida a la enfermedad de Alzheimer (enfermedad de Alzheimer sintomática temprana) que son heterocigotos o que no son portadores de apolipoproteína E ε4 (ApoE ε4) con patología amiloide confirmada.
Las nuevas indicaciones/modificaciones de indicaciones corresponden a Alhemo (concizumab) que recibe nueva indicación para la profilaxis rutinaria de hemorragias en pacientes de 12 años de edad o mayores con: Hemofilia A grave (deficiencia congénita del factor VIII, FVIII < 1%) sin inhibidores del FVIII y Hemofilia B moderada/grave (deficiencia congénita del factor IX, FIX ≤ 2%) sin inhibidores de FIX.
Taltz (ixekizumab) contará con nueva indicación para Artritis idiopática juvenil (AIJ) y Artritis psoriásica juvenil (APsJ). En monoterapia o en combinación con metotrexato, está indicado para el tratamiento de la APsJ activa en pacientes a partir de 6 años de edad y con un peso corporal de al menos 25 kg, que han presentado una respuesta insuficiente, o son intolerantes, al tratamiento convencional.
Finalmente Tevimbra (tislelizumab) recibe nueva indicación en combinación con quimioterapia basada en platino como tratamiento neoadyuvante y luego continuado en monoterapia como tratamiento adyuvante, está indicado para el tratamiento de pacientes adultos con CPNM resecable con alto riesgo de recidiva.















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: