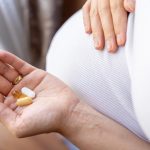
La Agencia Española de Medicamentos y Productos Sanitarios ha presentado la revisión de los perfiles de seguridad de 13 medicamentos en su último boletín correspondiente a los meses de agosto y septiembre. Entre las revisiones se incluye el descarte ya de forma oficial la ausencia de evidencia de una relación causal entre el uso de paracetamol durante el embarazo y el autismo en niños, una cuestión sobre la que ya se posicionó en el mismo sentido el pasado 23 de septiembre.
El origen este posicionamiento, tuvo que ver con la publicación el pasado 22 de septiembre de una nota de prensa por parte de la FDA (Food and Drug Administration) de Estados Unidos anunciando la posible asociación entre el uso de paracetamol durante el embarazo y diagnósticos posteriores de autismo o trastorno por déficit de atención con hiperactividad (TDAH). La Aemps informa de que el paracetamol puede utilizarse para reducir el dolor o la fiebre durante el embarazo, siempre que exista una necesidad clínica, siguiendo la recomendación de utilizar la dosis eficaz más baja, durante el menor tiempo posible y con la menor frecuencia posible.
Igualmente señala que los datos disponibles no han encontrado ninguna relación causal entre el uso de paracetamol durante el embarazo y el autismo u otros trastornos del neurodesarrollo.
Además de esta cuestión, la evaluación de los datos de farmacovigilancia de medicamentos de uso humano comercializados en España, incluye otras comunicaciones de seguridad. Entre ellas la correspondiente a colazapina en la que se realiza una actualización de las recomendaciones de controles hematológicos.
El PRAC (organismo de la Agencia Europea del Medicamento encargado de la farmacovigilancia) ha revisado la evidencia científica disponible sobre el riesgo de neutropenia y agranulocitosis asociado al tratamiento con clozapina. En base a ello, “recomienda que se reduzca la frecuencia de los controles hematológicos en los pacientes tratados con este antipsicótico”, señala la Aemps.
También se incluyen nuevas medidas para minimizar el riesgo de ideación suicida vinculado a finasterida, dutasterida.
La Aemps indica que la ideación suicida se ha identificado como una reacción adversa asociada al uso de finasterida oral, especialmente en pacientes tratados por alopecia androgenética. Por este motivo, “hay que advertir a estos pacientes que interrumpan el tratamiento y busquen consejo médico si experimentan estado de ánimo deprimido, depresión o pensamientos suicidas”.
Asimismo, se debe informar a los pacientes de la importancia de acudir a su médico en caso de presentar disfunción sexual debido a su contribución al desarrollo de alteraciones del estado de ánimo, incluida la ideación suicida. En estos casos, se valorará la conveniencia de interrumpir el tratamiento.
En cuanto a la dutasterida, aunque no existe evidencia suficiente para establecer una relación directa con el desarrollo de ideación suicida, debido al mecanismo de acción común de los inhibidores de la 5-alfa reductasa, se recomienda que los pacientes tratados con dutasterida consulten con su médico si presentan síntomas de alteraciones del estado de ánimo.
También ha valorado las reacciones adversas hematológicas y neurológicas atribuidas al acexamato de zinc. Según explican, en tratamientos de larga duración con acexamato de zinc hay que considerar la posibilidad de que se reduzcan los niveles de cobre en sangre. Se recomienda realizar un seguimiento analítico periódico que incluya vigilancia hematológica, determinación de lipoproteínas y análisis de orina a fin de detectar las manifestaciones tempranas de la deficiencia de cobre, tales como alteraciones de la médula ósea (anemia, leucopenia, neutropenia, bicitopenia o síndrome mielodisplásico), mielopatía y neuropatía periférica se incorporan como reacciones adversas. Asimismo, los médicos deben estar atentos a los síntomas sensoriales y motores, y así como a los signos que potencialmente puedan indicar neuropatía incipiente o mielopatía.
Otro de los perfiles estudiados han sido las reacciones cutáneas graves derivadas del uso de bupropión. Se han notificado casos de reacciones adversas cutáneas graves (SCARs, por sus siglas en inglés) en pacientes tratados con bupropión, incluyendo síndrome de Stevens-Johnson (SSJ), necrólisis epidérmica tóxica (NET), pustulosis exantemática generalizada aguda (AGEP, por sus siglas en inglés), y reacción a fármaco con eosinofilia y síntomas sistémicos (DRESS, por sus siglas en inglés). Estas reacciones pueden comprometer la vida del paciente o resultar mortales.
“Hay que advertir a los pacientes sobre los signos y síntomas de estas reacciones y realizar un seguimiento estrecho para detectarlas. Ante la sospecha de SCAR hay que suspender de inmediato el tratamiento con bupropión y considerar un tratamiento alternativo, según corresponda. Si el paciente desarrolla una SCAR, el tratamiento no se debe reiniciar en ninguna circunstancia”, indica la Aemps.
Por otro lado, también ha analizado la falta de eficacia de caspofungina, con el uso de membranas de poliacrilonitrilo. En pacientes sometidos a tratamiento sustitutivo renal (TSR) continuo, la utilización de membranas derivadas de poliacrilonitrilo (por ejemplo, durante hemofiltración o hemodiafiltración) puede provocar la adsorción de caspofungina, disminuyendo su eficacia terapéutica. El incremento de la dosis puede no evitar este efecto, por lo que “se recomienda utilizar una membrana extracorpórea alternativa o emplear otro medicamento antifúngico”.
También se ha pronunciado en relación al uso de la ciclosporina en lactancia. “En la mayoría de los casos, la ciclosporina no fue detectable en la sangre de los lactantes. Sin embargo, a pesar de que la concentración en leche materna era baja, en algunos casos se han registrado concentraciones sanguíneas que oscilan desde niveles detectables hasta niveles terapéuticos”.
Por otro lado, la Aemps indica que “antes de iniciar el tratamiento con dexketoprofeno-tramadol, debe acordarse con el paciente la duración y los objetivos del tratamiento, así como un plan de interrupción del mismo”. Durante el tratamiento, se recomienda mantener un contacto frecuente entre el médico y el paciente para evaluar la necesidad de continuar el tratamiento, considerar su interrupción y ajustar las dosis si es necesario. Cuando un paciente ya no necesite el tratamiento, puede ser aconsejable reducir la dosis gradualmente para prevenir los síntomas de abstinencia. Si el control del dolor es inadecuado, debe considerarse la posibilidad de hiperalgesia, tolerancia o progresión de la enfermedad subyacente.
Por otro lado la Aemps ha informado que se han notificado casos de síndrome hemolítico urémico atípico (SHUa) en pacientes que recibieron dinutuximab beta, algunos casos con desenlace mortal. “Se deben vigilar los signos y síntomas del SHUa y, si se confirma el diagnóstico, tratar de inmediato y suspender el tratamiento con dinutuximab beta de forma permanente”, indica la Agencia.
En relación con el disodiohidrógeno fosfato/ fosfato de sodio dihidrógeno, fosfato sódico (formulaciones para administración rectal), el regulador indica que el uso de estos medicamentos conlleva un riesgo de niveles elevados de sodio y fosfato en sangre y de disminución de los niveles de calcio y potasio, pudiendo provocar hipernatremia, hiperfosfatemia, hipocalcemia e hipopotasemia, que pueden manifestarse como tetania e insuficiencia renal.
Por otro lado, en relación a osimertinib, la Aempos señala que la reactivación del virus de la hepatitis B (VHB) puede producirse en pacientes tratados con osimertinib que, en algunos casos, puede desencadenar hepatitis fulminante, insuficiencia hepática o muerte. Hay que realizar seguimiento de los pacientes con serología positiva para el VHB con el fin de detectar signos clínicos o parámetros de laboratorio compatibles con la reactivación del VHB mientras reciben el tratamiento. “En los pacientes que desarrollen reactivación del VHB hay que suspender el tratamiento y tratar de acuerdo con las guías clínicas”, afirman.
En relación con el tratamiento concomitante de testosterona e inhibidores del cotransportador de sodio-glucosa tipo 2 (SGLT-2) se ha asociado a un mayor riesgo de eritrocitosis. Dado que ambas sustancias pueden elevar de forma independiente los niveles de hematocrito, es posible un efecto acumulativo. Por ello, se recomienda vigilar los niveles de hematocrito y hemoglobina en los pacientes que reciben ambos tratamientos.
Las presentaciones inyectables oleosas con testosterona deben administrarse exclusivamente por vía intramuscular y de forma muy lenta.
En relación con tezacaftor/ivacaftor se han notificado casos de insuficiencia hepática que han requerido trasplante en los primeros 6 meses de tratamiento, tanto en pacientes con enfermedad hepática avanzada preexistente como sin ella. “Si un paciente presenta signos o síntomas de daño hepático, hay que interrumpir el tratamiento y determinar las transaminasas y la bilirrubina total. Se debe controlar estrechamente a los pacientes que reanuden el tratamiento tras la interrupción”.
En relación al uso de tiocolchicósido/paracetamol en el embarazo, la Aemps indica que “el uso de métodos anticonceptivos se debe prolongar en mujeres durante 1 mes después de suspender el tratamiento y se contraindica en hombres que no deseen utilizar métodos anticonceptivos eficaces durante el tratamiento y los 3 meses posteriores a la interrupción del mismo”.
También ha informado que se han notificado casos de botulismo iatrogénico tras la administración de productos que contienen toxina botulínica. Es importante advertir a los pacientes o cuidadores que busquen atención médica inmediata si experimentan signos o síntomas compatibles con la diseminación del efecto de la toxina botulínica, especialmente si se presentan alteraciones de la deglución, el habla o la respiración. En caso de diseminación de la toxina, el paciente debe ser vigilado médicamente para detectar síntomas de debilidad muscular excesiva o parálisis muscular.
Finalmente en lo referente a somatrogon se señala que el sitio de inyección debe rotarse en cada administración para prevenir la lipoatrofia.















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: