"Hasta que no tengamos claro que la vacuna o vacunas que van a estar disponibles van a ser eficaces y seguras no se van a utilizar en la población. Cuando tengamos datos que garanticen su seguridad será cuando empezaremos a utilizar las vacunas completando la vacunación de los grupos prioritarios". Así de rotunda se mostró Aurora Limia, jefa del Área de Programas de Vacunación en la Dirección General de Salud Pública del Ministerio de Sanidad, en relación con la política que piensa seguir el Ministerio en relación con las vacunas para la covid-19.
Ese mensaje fue reforzado por María Jesús Lamas, directora de la Agencia Española de Medicamentos y Productos Sanitarios, quien puso al organismo que dirige como uno de los garantes de que las vacunas que se van a utilizar tendrán garantizada "la calidad en su fabricación, y van a demostrar su eficacia y seguridad". En este sentido, aseguró que los procesos que se van utilizar "van a ser los mismos que para cualquier otra situación de emergencia sanitaria". "Pueden cambiar las consideraciones políticas para el acceso, pero no los criterios científicos con los que se van a evaluar", añadió. De hecho, Lamas se atrevió a decir que "posiblemente nunca se ha puesto tanto empeño en disponer de una vacuna eficaz y segura para la población".
Sobre la seguridad de estas vacunas habló también Agustín Portela, jefe del Área de Biotecnología y Productos Biológicos del Departamento de Medicamentos de Uso Humano de la Aemps, quien defendió también el principio de seguridad como "primordial". A este respecto, recordó que se trata de administrarla en personas sanas, lo que obliga a que "los riesgos tienen que ser muy pequeños". "Eso lo tenemos muy presente las agencias y la autoridades de Salud Pública", deslizó.
Con respecto al proceso para garantizar la seguridad, explicó que "antes de pinchar a un humano, ya se ha probado la seguridad en animales", en referencia a los ensayos preclínicos. Después, continuó, "pasamos a evaluarla en humanos, en fase I, con decenas de personas; II, con centenas, y III, con miles". "En esos ensayos, se mira la seguridad a corto plazo, en relación con los efectos adversos esperados (dolor, enrojecimiento, fiebre). Posteriormente, se realiza seguimiento durante un mes de efectos adversos graves, evaluando su relación con las vacunas y en los meses siguientes, se evalúan las enfermedades que requieran hospitalización o muerte y su relación con la vacuna. Con todos esos datos, las agencias miramos si el riesgo es asumible en relación con el beneficio que aporta la vacunación", aclaró.
Además, lanzó un mensaje tranquilizador, consistente en que la vigilancia de seguridad nunca acaba, ya que, una vez comercializadas, seguirán activos los sistemas de farmacovigilancia para que sean notificadas las posibles reacciones adversas, que serán evaluados y, de ser necesario, se procederá a una actualización de la ficha técnica "para minimizar el riesgo". Por tanto, concluyó, "la vigilancia de la seguridad comienza antes de pinchar a la primera persona y se mantiene cuando ésta se comercializa", por lo que no termina nunca.
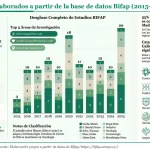
Lamas añadió a esto la información que tendrán que generar los laboratorios a través de estudios postautorización, que "serán parte de las condiciones de la EMA", así como la referida a la efectividad y seguridad en vida real "a través de estudios masivos de datos", a la que la Aemps va a contribuir con los de la base de datos Bifap. "Se ha planteado desde Europa la necesidad de evaluar qué pasa en vida real para reaccionar rápido si surge un efecto inesperado", ha dicho.
La directora de la Agencia también trató de poner en contexto las suspicacias que pueden resultar de los tiempos tan cortos que se están empleando para el desarrollo de las vacunas para la covid-19. En este sentido, afirmó que "nunca antes había habido un dispositivo tan amplio e integral de recursos y talento" para el desarrollo de un producto de estas características. Tanto es así que esas cifras de pacientes a las que aludía Portela, en este caso, se habrían multiplicado, "con fases I que incluyen a cientos de participantes, fases II con miles y fases III con decenas de miles", lo que permite "disponer de amplios volúmenes de datos" en poco tiempo.
Finalmente, Lamas ha anunciado que la información sobre las vacunas estará accesible en el Centro de Información de Medicamentos (CIMA), incluida la ficha técnica tienen previsto además elaborar "material divulgativo cuando esté más avanzada la vacuna, para hacer más comprensibles los datos que tengamos".















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia:
2 comentarios
Todo lo que este avalado por los Drs Aurora Limia y Agustín Portela es de la máxima garantía. Cordiales saludos. Paco. Francisco Salmerón García. Virólogo. Funcionario Jubilado. Ex jefe de la División de Productos Biológicos y Biotecnología de la Agencia Española del Medicamento y Productos Sanitarios. Miembro de los Comités de erradicación de la Poliomielitis, el sarampión y la rubeola de España.
Cualquier vacuna que tenga el visto bueno de Aurora Limia y de Agustín Portela , tiene las máximas garantías. Cordiales saludos. Paco. Francisco Salmerón García. Virólogo . Funcionario Jubilado. Exjefe de la División de Productos Biológicos y Biotecnología de la Agencia Española del Medicamento. Miembro de los Comités de Erradicación de la poliomielitis , la rubeola y el sarampión de España.