La investigación y desarrollo de medicamentos para enfermedades poco frecuentes ha sido una historia de éxito en Europa y en el mundo. Los incentivos han ejercido su papel y han propiciado la puesta en el mercado de numerosos medicamentos que han cambiado la vida de miles de personas. No obstante, el desarrollo, gestión y manejo de los medicamentos huérfanos y ultra huérfanos no está exenta de retos, que requieren ser abordados para asegurar que esta historia de éxito continúe.
Con el objetivo de analizar estos retos y ahondar en las cuestiones clave relativas a los medicamentos huérfanos desde diferentes perspectivas, Diariofarma con la colaboración de Chiesi, Sobi y BioMarin ha iniciado un ciclo de encuentros que tiene como objetivo profundizar en aspectos como la situación actual, los cambios en materia legislativa farmacéutica, tanto europea como nacional, que afectarán a estos productos, su valor social o los retos de acceso entre otros.
Este primer encuentro, centrado en aspectos de autorización, financiación y precio de los medicamentos huérfanos, contó con la participación de Carlos Martín Saborido, vocal asesor de la Dirección General de Cartera Común de Servicios del SNS y Farmacia del Ministerio de Sanidad (DGCCSF); José María Moraleda, ex presidente de la Sociedad Española Hematología y Hemoterapia (SEHH); Ana María Martín de Rosales, farmacéutica especialista en Enfermedades Raras (EERR) del Hospital Alcorcón; Isabel Motero, directora general de la Federación Española de Enfermedades Raras (Feder) y su Fundación; Marian Corral, directora de la Asociación Española de Laboratorios de Medicamentos Huérfanos y Ultra huérfanos (Aelmhu) y José Vicente Galindo, Pricing & Market Access Associate Director de Chiesi España y fue moderado por José María López Alemany, director de Diariofarma.
El encuentro comenzó con un análisis de la situación actual, donde se abordaron los retrasos en el acceso por la larga tramitación de la financiación y precio. En este sentido, Carlos Martín Saborido expuso que desde la DGCCSF se está realizando un exhaustivo análisis, al día de hoy, prácticamente finalizado, para determinar “dónde se encuentran la mayor parte de los retrasos”. El análisis, explicó, intenta identificar más de manera cualitativa el porqué de estos retrasos y donde se encuentran “los cuellos de botella”.

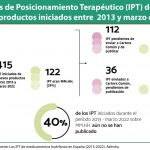
A este respecto, explicó que afrontar estos cuellos de botella podría reducir el tiempo de tramitación en un 35%, lo que supondría adelantar “hasta 200 días la aprobación”. La primera versión de una infografía que presenta todos los procesos y las oportunidades de ahorro de tiempo se publicará en breve en la página web del Ministerio de Sanidad.
Por otro lado, Martín Saborido recordó que muchos de los procedimientos actuales tendrán que ser modificados una vez que se empiecen a recibir los joint clinical assessment (JCA) establecidos en el nuevo Reglamento Europeo de Evaluación de Tecnologías Sanitarias (HTA, por sus siglas en inglés), teniendo en cuenta que la mayoría de los medicamentos huérfanos entrarán por esta vía. Por ese motivo, apuntó que la estructura de los informes de posicionamiento terapéutico (IPTs), así como la evaluación y la participación de los stakeholders tendrá que modificarse.
Martín Saborido también expuso algunos detalles del nuevo Real Decreto de Evaluación de Tecnologías Sanitarias que será expuesto para alegaciones próximamente. Según adelantó, la implicación de los clínicos en la elaboración de los IPT “será mucho mayor y no solo en cantidad sino también en especialización”. Además, concretó que en el Real Decreto la estructura se encontrará “muy bien definida en relación con los comités y el tiempo, por lo que el procedimiento que se establece ayudará a mejorar los plazos”.
Por su parte, José María Moraleda mostró su satisfacción ante los estudios que se están realizando. No obstante, quiso poner de manifiesto que “diez años más tarde se sigue en el mismo punto” y por ello, apuntó la conveniencia de observar y aprender de algunos modelos de otros países europeos que cuentan con sistemas más ágiles. Para este experto, es fundamental “obtener datos científicamente para poder resolver esta situación”.
En relación con la elaboración de los IPTs Moraleda reclamó la necesidad de incluir a las sociedades científicas, que pueden aportar profesionales “no sesgados”, a diferencia de lo que ocurre en la actualidad, donde cada administración escoge a sus expertos de confianza. En ese sentido, incidió en que las sociedades científicas están “absolutamente dispuestas” e implicadas, y destacó que incluso, realizan IPTs paralelos, los cuales deberían aprovecharse o utilizar de forma conjugada con los que se elaboran. Con ello, según dijo, “se facilitaría el proceso”.
Mejora en los plazos
Pese al mal dato general de plazos de aprobación, Marian Corral reconoció que en los últimos tiempos “ha habido ciertas mejoras” en los tiempos de espera, que se han reducido. No obstante, Marian Corral añadió que es necesario tener en cuenta que en los datos que se facilitan no se incluyen los retrasos a nivel autonómico ya que se trabaja desde la otorgación del código nacional a la decisión de financiación.
En cuanto a la elaboración de los IPTs, la representante de Aelmhu destacó que “están expectantes” ante la nueva regulación europea y sobre todo teniendo en cuenta la sentencia donde se acordó la anulación de REvalmed, lo que según dijo, conlleva la “necesidad de repensar cuál es realmente el modelo de IPTs que España necesita” para adaptarlo a la llegada de JCA europeos.

Por su parte, Isabel Motero puso el foco en el impacto que produce en los pacientes de enfermedades raras esta situación. “Es muy difícil para una organización explicar la situación actual a los pacientes y acompañarlos en el manejo de estas expectativas”, en ocasiones es fácil de resolver, pero en otras, “muy complicadas”.
La representante de Feder enfatizó en la necesidad de trabajar con los pacientes, ya que estos solo pueden acceder a los borradores de los IPTs, pero “su papel no es vinculante”. Para ella, su participación es esencial ya que debe tenerse en cuenta cuál es su opinión de cómo impacta el tratamiento en su calidad de vida. Adicionalmente, reclamó la participación de los pacientes en la Comisión Interministerial de Precios de Medicamentos (CIPM), ya que, según dijo, tanto los pacientes como los profesionales sanitarios deben “estar en el proceso de decisiones”.
Evaluaciones y datos
Por su parte, Ana María Martín también destacó que “se ha producido un gran cambio en los últimos años” y se han acelerado los procedimientos y autorizaciones, ya que “el porcentaje de medicamentos aprobados ha sido superior e incluso se ha producido la reevaluación de medicamentos que no estaban autorizados”, añadió. No obstante, para esta farmacéutica hospitalaria, el cuello de botella no se encuentra no solo a nivel burocrático sino también en la falta de información. Para ella “existe una gran dificultad en analizar con certeza cuál es el impacto presupuestario que supone la aprobación de estos medicamentos”. Además, esta farmacéutica puso sobre la mesa la labor que se realiza por los profesionales sanitarios al realizar estas evaluaciones fuera del horario laboral y con carácter altruista, lo que hace “cada vez es más difícil” su participación. Por ello, fue contundente al afirmar que es necesario una reestructuración para conseguir que existan profesionales que puedan dedicar tiempo no solo a la evaluación y toma de decisiones, sino también a la gestión de los datos de este tipo de medicamentos.
Ana María Martín también introdujo un elemento clave en el manejo de los medicamentos huérfanos. La farmacéutica planteó los problemas que surgen al utilizar un medicamento en situaciones especiales, si posteriormente no resulta financiado en nuestro país. Esta farmacéutica consideró importante utilizar la información que se genera en esos usos expandidos para la toma de decisiones sobre financiación.
La visión de la industria farmacéutica fue aportada por José Vicente Galindo, quien señaló que, pese a que los incentivos y los mecanismos fast track han funcionado para que al día de hoy se cuente con un portfolio de medicamentos huérfanos que han funcionado, aún quedan muchos medicamentos por “entrar en la financiación”. Esta situación, según dijo, “es realmente un fallo del sistema” y supone uno de los mayores desincentivos para la investigación. Por eso planteó que los pagadores deberían tener en cuenta la disyuntiva entre las eficiencias dinámicas y estáticas en relación con elegir si se paga poco para tener ahorros a corto plazo o si se paga más para incentivar desarrollos a largo plazo.
Galindo también destacó que “desde hace pocos años se está viviendo una época de transparencia y colaboración” muy superior a la previa y planteó que es necesario “remar todos juntos” para dar respuesta a los retos existentes en materia de financiación y acceso a los medicamentos. Por ese motivo reclamó ver a la industria “como parte de la solución y no del problema”. A este respecto, señaló como clave “contar con colaboración, transparencia, confianza y un marco estable”, aseguró. Igualmente reclamó la participación de otros agentes, como la industria o los pacientes en las comisiones de decisión.
Diálogo y gestión de la incertidumbre
En relación con los medicamentos que llegan con incertidumbres, Galindo consideró necesario “mojarse” y utilizar herramientas, como los precios dinámicos u otros mecanismos, que permitan un uso acelerado de estos medicamentos.
Al hilo de todas estas cuestiones, Martín Saborido consideró fundamental el diálogo público-privado, y que este se realice de forma temprana, pero se centró en la relevancia de contar con la adecuada información para la toma de decisiones. En este sentido, explicó que en el Real Decreto de Evaluación de Tecnologías Sanitarias se contempla que las evaluaciones puedan tener en cuenta toda la información disponible para la toma de decisiones. A este respecto citó la utilización de los IPTs realizados de forma paralela por las sociedades científicas o la generada a través de los usos especiales y acceso temprano de los medicamentos, como había expuesto Ana María Fernández.

Por otro lado, el vocal asesor de la Dirección General abordó el papel que tendrá la CIPM a partir del RD de ETS. Según dijo, con el objetivo de separar la evaluación de la decisión, la Comisión de Precios solo decidirá la financiación y el precio en función de un posicionamiento y una evaluación realizada por técnicos previamente. A este respecto, y en respuesta a Ana María Martín, confirmó que los evaluadores que participen serán compensados.
Los participantes concluyeron de forma unánime en la necesidad clara de apostar por un procedimiento de financiación y fijación de precio adecuado a los medicamentos huérfanos, que tenga en cuenta las incertidumbres propias de estos medicamentos. Igualmente, se consideró que estos medicamentos deben quedar excluidos de las evaluaciones económicas ya que los resultados serían siempre negativos.
También se coincidió, en la necesidad de contar con los profesionales sanitarios y todas las personas implicadas. Destacándose como uno de los grandes retos el contar con sistemas y herramientas informáticas interoperables para la actualización de registros nacionales y la posibilidad de una mayor obtención de datos imprescindibles para la toma de decisiones. Todo ello sin olvidar, que es fundamental contar con suficientes recursos humanos y económicos.
La directora de Aelmhu señaló que es importante dar continuidad a los mecanismos de gestión de la incertidumbre implementados. No obstante, según ella “falta claridad y flexibilidad”, ya que estos medicamentos presentan una serie de características que deben ser tenidas en cuenta para el diseño de cada mecanismo, que debe ser individualizado y ser flexible.
Por su parte, la representante de Feder planteó la necesidad de establecer procedimientos transparentes en los que, además, puedan participar los pacientes y que estos accedan a conocer el porqué de las decisiones de financiación.
Para Martín Saborido está claro que hay que “sacar a los huérfanos del circuito habitual de precio-financiación”, y en este sentido, aseguró que están analizando métodos distintos. Por otro lado, el representante de la DGCCSF puso de manifiesto que no debe olvidarse que el sistema sanitario debe ser sostenible. Para ello debe contar con una sistema que priorice las necesidades médicas socialmente más relevantes, ya que en ocasiones el beneficio clínico relevante “es muy bajo”. En este contexto, Martín Saborido hizo referencia al proyecto en el que están trabajando con los Países Bajos en el que se intenta concienciar a la industria farmacéutica para que investigue “lo que hace falta”, con el objetivo de lograr avanzar hacía una “investigación socialmente comprometida”. Para lograrlo, planteó que la Administración debe ejercer su “poder de compra”.
En relación a la equidad, los expertos que participaron concluyeron que es necesario avanzar en este sentido, ya que tal y como apuntó Moraleda se trata de un asunto que viene generado por la “multiplicación de administraciones”. Por su parte, Isabel Motero también puso el foco en las inequidades que se producen a nivel autonómico, ya que según dijo, “muchas personas que acceden por vía extranjera a los medicamentos, en algunas comunidades se aprueban y en otras no”. Esta situación, “es muy difícil de explicar a los pacientes", concluyó.

















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: 