Ya se han cumplido dos años desde la puesta en marcha del el Plan para el Abordaje de las Terapias Avanzadas en el SNS y en el último balance ofrecido por el Ministerio, eran 182 los pacientes que habían sido tratado con terapias CAR-T. Las solicitudes, a 31 de octubre de 2020, habían sido 386.
En el balance oficial, se han conseguido tres objetivos clave: organizar el empleo de estos medicamentos, así como impulsar la investigación pública y la fabricación “propia y pública” de los mismos. En la reflexión de los expertos sobre la cuestión hay también desafíos pendientes de superarse.
Ramón García Sanz, presidente de la Sociedad de Hematología y Hemoterapia (SEHH), considera un acierto que el Ministerio contara desde el primer momento con un “grupo de verdaderos expertos, con nombres y apellidos” que ha ejercido su influencia en la implantación de las CAR-T en España. No obstante, también aprecia la necesidad de mejorar los procedimientos para descargarlos de trámites burocráticos que lastran el proceso desde la indicación hasta la llegada de la terapia, lamentando que “se pierdan muchos pacientes”. A su modo de ver, siguen siendo tratamientos poco accesibles, y es importante mejorar esta dimensión del plan.
García Sanz está convencido de que este tipo de terapias “han venido para quedarse, seguramente extiendan sus indicaciones y hay que ver cómo hacerlo sostenible entre todos; sobre todo la administración que no debe dormirse en los laureles”. Su balance del plan es positivo, lo cual no impide ver que se le va a exigir aún más.
Para Regina Quiroga, directora de Medical Affairs de Kite, una compañía de Gilead, el Plan Nacional de Terapias Avanzadas ha demostrado ser una herramienta eficaz para su implementación durante este tiempo, “pero parece que estamos en el momento de seguir evolucionando”.
A su modo de ver, la llegada de nuevas terapias, la pandemia y las experiencias de los pacientes han demostrado que es necesaria la reevaluación del número de centros, la reducción de los plazos burocráticos y una mayor formación y coordinación con los centros de referencia.
Quiroga identifica un margen para la mejora en el compromiso de seguir trabajando “especialmente en la reducción de los tiempos, simplificando el proceso de solicitud, ya que en estos pacientes cada día cuenta”. Además, aboga por un abordaje multidisciplinar aún mayor para las terapias avanzadas; por mejorar la formación tanto de los profesionales implicados como de los propios pacientes y valorar incrementar el número de centros cualificados.
Esta última posibilidad fue descartada por el Ministerio en el momento de realizar su último balance (a finales de 2020), con Salvador Illa aún al frente de la cartera, en una información recogida por Diariofarma.
Por su parte, Reyes Calzada, directora médica de Oncología en Novartis, opina que el reto más importante que queda por superar es la ampliación y futuras indicaciones para otras enfermedades hematológicas y oncológicas “y que puedan beneficiarse de ellas más pacientes”.
“Actualmente estamos viviendo los primeros pasos de la aplicación comercial de las terapias CAR-T en tumores hematológicos. El paso natural es la aprobación de nuevos tratamientos, por ejemplo, nuestra compañía tiene ensayos clínicos en más de ocho indicaciones diferentes, en distintas fases. En tumores sólidos, por el mecanismo de acción de este tipo de terapias, su aplicación es más compleja. En Gilead estamos trabajando en este sentido y somos optimistas pero también prudentes”, indica Quiroga.
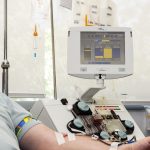
CAR-T disponibles y ¿accesibles?
Con la incorporación del 'académico' ARI-0001 en febrero, el arsenal terapéutico de CAR-T en España consta de tres terapias de este tipo.
La Aemps aprobó el uso como medicamentos de terapia avanzada de fabricación no industrial ARI-0001, desarrollado por el Hospital Clínic, para su utilización en pacientes mayores de 25 años con leucemia linfoblástica resistente a los tratamientos convencionales. La autorización excepcional de uso por parte de la Aemps, de hecho, forma parte del Plan de Terapias Avanzadas.
Próximamente también llegará a nuestro país Tecartus (células CD3+ autólogas, anti-CD19-transducidas; anteriormente KTE-X19), desarrollado también por Kite, que ya cuenta con la autorización de comercialización condicional emitida por la Comisión Europea.
Los otros CAR-T disponibles en España son axicabtagene ciloleucel (Yescarta) de Gilead y tisagenlecleucel (Kymriah) de Novartis. Ambos se aprobaron con esquemas de riesgo compartido.
Las indicaciones cubiertas por estas las tres CAR-T comercializadas en nuestro país son leucemia linfoblástica aguda de células B refractario o en recaída, linfoma B difuso de células grandes en recaída o refractario a dos o más líneas de tratamiento sistémico, y linfoma B primario mediastínico de células grandes después de dos líneas o más de tratamiento sistémico. La cuarta, Tecartus cuenta actualmente con indicación para adultos con linfoma de células del manto en recaída o refractario.
García Sanz indica que el número de solicitudes para la autorización de CAR-T que terminan llegando al tratamiento es relativamente pequeño: “Se pierde aproximadamente un 50%”. Una parte sustancial se debe al deterioro de los pacientes, con una espera de 20-30 días para el acuerdo de financiación y otros tantos hasta que reciben la terapia. Admitiendo que parte del problema se deriva de las dificultades técnicas inherentes a procesos de alta complejidad como estos, lamenta que “desde la indicación hasta la infusión se pierden pacientes, o bien se opta por tratamientos más accesibles, como anticuerpos monoclonales bioespecíficos o nuevas combinaciones”, declara.
Cuando se mira al futuro, los responsables del desarrollo de terapias de este tipo piensan en tecnologías de fabricación que permitan acelerar y reducir los costes de producción de las CAR-T. Es parte del plan que Ann Lee, vicepresidenta de la división de desarrollo y operaciones de terapias celulares de Bristol-Myers Squibb (BMS) presentaba en un reciente encuentro con los medios de comunicación, aunque la tecnología específica a la que se refiere aún está en fase de investigación preclínica.
La compañía se encuentra en fase de expansión de sus instalaciones para procesar terapias CAR-T tras la reciente aprobación de lisocabtagene maraleucel (Breyanzi) en Estados Unidos.
Real world evidence (RWE) de las terapias CAR-T
Aunque los hospitales van recopilando datos de series de pacientes para su análisis, no abundan las publicaciones científicas con evidencia en práctica clínica.
En octubre de 2020, un equipo de investigadores franceses anunciaba la próxima publicación de un análisis de este tipo sobre pacientes tratados en el Hospital Saint Louisde París en la revista Blood Advances, una revista de la Asociación Americana de Hematología (ASH). Catherine Thieblemont, que presentó la evidencia en el congreso anual de la SEHH, explicó entonces que los datos de los “rigurosos ensayos clínicos” se habían validado en la práctica clínica. Su equipo analizó los resultados de tisagenlecleucel y axicabtagene ciloleucelen dos series de 49 y 67 pacientes, respectivamente. En el momento de editar estas líneas la publicación no se había producido aún.
De acuerdo con los últimos datos proporcionados por el Ministerio, solo se dispone del resultado de la administración de CAR-T en 96 pacientes.
Regina Quiroga tiene claro que el mejor aspecto -desde la experiencia de su compañía- “están siendo los resultados en vida real”. Recuerda que ha sido presentada en el congreso Europeo de Trasplante (EBMT) la primera experiencia española recogida en casi 100 pacientes tratados con axicabtagene ciloleucel, que califica de “éxito”.
A este respecto, Reyes Calzada se remite a la publicación de datos en vida real en Estados Unidos, donde antes se aprobaron estas terapias. En el caso de tisagenlecleucel estos datos provienen de un registro prospectivo llevado a cabo por el CIBMTR (Center for International Blood and Marrow Transplant Research). En este estudio, se incluyeron en el análisis 255 pacientes tratados con tisagenlecleucel para la indicación de leucemia aguda linfoblástica. La tasa inicial de remisión completa fue del 85,5%. Con una mediana de seguimiento de 13,4 meses, las tasas de duración de la respuesta y supervivencia global a los doce meses fueron de 60,9% y 77,2%, indica.
En la indicación de linfoma difuso de células grandes se incluyeron en el análisis 155 pacientes, y los resultados muestran una tasa de respuesta global del 61,8%, incluida una RC inicial de 39,5%. “Las conclusiones de los autores tanto en la indicación de linfoma difuso de células grande y leucemia aguda linfoblástica muestran resultados con similar eficacia similar y seguridad mejorada en comparación con los observados en los ensayos de registro”, apunta Calzada.
¿Hay cambio de paradigma?
Quiroga considera que “lo que mejor responde al cambio de paradigma son las cifras”. Según los datos publicados a cuatro años en el último congreso americano de hematología (ASH) se ha producido un hito histórico en este tipo de terapias avanzadas. “Para determinados pacientes quedan muy atrás los seis meses de supervivencia en patologías como el linfoma B difuso de células grandes. Además, tras la autorización europea esperamos con ilusión la llegada de nuestro segundo CAR-T con indicación en linfoma de células del manto en recaída, donde hay una necesidad urgente no cubierta a la que podemos responder, tal y como han reconocido las autoridades sanitarias”, declara.
Sin duda las terapias CAR-T, como terapias avanzadas, suponen una transformación en el enfoque de enfermedades oncohematológicas, asegura Calzada. “En Novartis estamos liderando la investigación en terapias avanzadas –génicas y celulares-, que suponen hablar de medicina personalizada. Una medicina que ofrece un valor para los pacientes, la sociedad y también para los sistemas sanitarios como opción de tratamiento transformador, potencialmente curativo y de una sola dosis que proporciona una respuesta duradera para pacientes que actualmente no tienen otras opciones de tratamiento”.
Por su parte, Krishnan Viswanadhan, vicepresidente de terapias celulares en BMS, apunta: “El tratamiento del cáncer se ha hecho más global, se aborda desde la inmuno-oncología cuando se trata de desarrollar y emplear nuevos tratamientos para los pacientes, ahí está el cambio de paradigma”.
La población de pacientes, mañana
Quiroga rescata en su reflexión datos del último informe Génesis del grupo de trabajo de la SEFH, según el cual en España la población diana para pacientes adultos con linfoma B difuso de células grandes (LBDCG) en recaída tras el fracaso de la 2ª línea con esquema habitual está cercana a los 500 pacientes; y para pacientes menores de 25 años con LLA es de 60.
Las próximas indicaciones que se esperan (pendiente de los resultados de los estudios de registro) van a elevar el número de pacientes candidatos de forma sustancial.
En tumores sólidos existe mucha investigación preclínica pero todavía no se ha avanzado en terapia CAR-T hacia poblaciones específicas para obtener aprobaciones por agencias regulatorias, apunta Calzada.
En cualquier caso, la previsión es que se extenderán las indicaciones y la población de candidatos a ser tratados con CAR-T.
“El mejor aspecto de la terapia CAR-T es el potencial curativo de estas terapias a largo plazo, de acuerdo con los resultados de los ensayos de registro”, valora Reyes Calzada.
Se buscan fórmulas para que lleguen a todos.


















 Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia:  Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados:
Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados:  Margarita de la Pisa, eurodiputada de Vox.:
Margarita de la Pisa, eurodiputada de Vox.: