Tal y como se preveía, dado el fuerte impulso político para lograrlo, el último trílogo político del año para la aprobación del Paquete Farmacéutico, terminó con la fumata blanca del acuerdo a altas horas de la madrugada de este 11 de diciembre.
El acuerdo provisional alcanzado entre Parlamento y Consejo supone la mayor reforma del mercado farmacéutico europeo en más de dos décadas, un paquete legislativo que redefine los pilares de acceso, disponibilidad, incentivos y supervisión del medicamento en la Unión. Se busca, entre otras cuestiones, impulsar la innovación, afrontar el reto de las resistencias a los antimicrobianos y afrontar de forma estructural retos como los desabastecimientos, la competencia efectiva tras el fin de la exclusividad o la aparición de resistencias antimicrobianas.
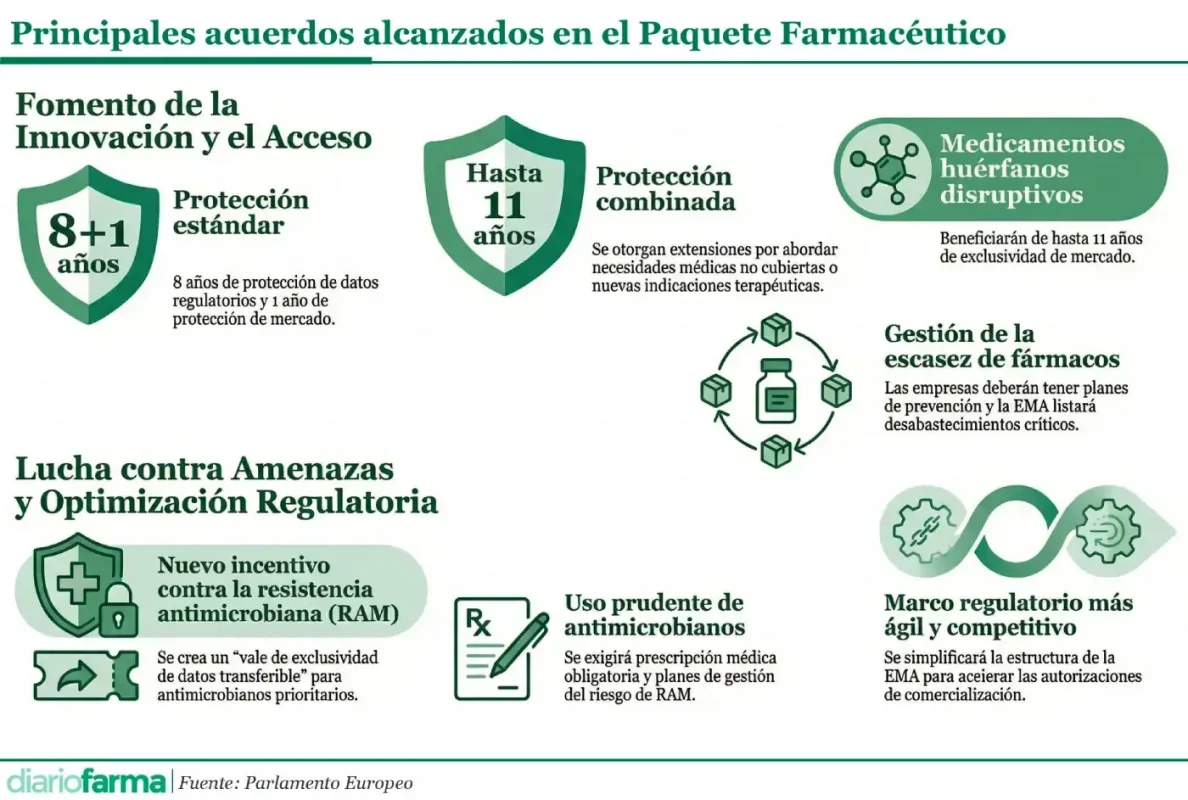
La reforma, tal y como adelantó Diariofarma, fija un periodo total de protección a la innovación de hasta once años. En concreto, se dividirá en diferentes situaciones, comenzando por ocho años de protección de datos regulatorios, durante el cual ninguna otra compañía puede acceder a la información del producto, seguido de un año adicional de protección de mercado, que impide la comercialización de genéricos o biosimilares tras la autorización. Además, las compañías podrán optar a ampliaciones de doce meses si el medicamento aborda una necesidad médica no cubierta, si contiene una nueva sustancia activa y cumple una combinación de requisitos, como puede ser la realización de ensayos clínicos comparativos, estudios realizados en varios Estados miembros y la obligación de solicitar la autorización de comercialización en la UE en los noventa días posteriores a la primera solicitud fuera de la Unión, o si obtienen una nueva indicación terapéutica que aporte un beneficio clínico significativo frente a las alternativas existentes.
La propuesta revisa también el marco para los medicamentos huérfanos con el fin de orientar mejor las recompensas regulatorias hacia aquellas patologías con mayor impacto no atendido. De forma paralela, se impulsa el desarrollo de genéricos y biosimilares con el objetivo de favorecer la competencia una vez expiren las exclusividades, condición clave para la sostenibilidad de los sistemas sanitarios europeos.
En conjunto, la reforma establece un límite máximo de once años para la suma de todas las protecciones regulatorias posibles. Un sistema de incentivos más dinámico, objetivo desde el principio para la Comisión Europea, en el que los periodos de exclusividad de datos se podrán modular según el cumplimiento de obligaciones de diversa naturaleza.
Obligaciones de suministro y antimicrobianos
El acuerdo introduce también obligaciones más estrictas de suministro, que buscan prevenir interrupciones y reducir la exposición a tensiones en la cadena logística. Los titulares de autorización deberán notificar con mayor antelación posibles riesgos de falta de suministro y contar con planes reforzados de continuidad. A esto se suma una actualización de las herramientas de supervisión para mejorar la capacidad de respuesta ante crisis sanitarias y amenazas transfronterizas.
Otra de las piezas centrales es la iniciativa para combatir las resistencias antimicrobianas, considerada por el Parlamento como una de las mayores amenazas actuales para la salud pública. El acuerdo plantea medidas que fomentan la investigación de nuevos antimicrobianos, fortalecen el uso prudente de los antibióticos e incorporan elementos de información dirigidos a profesionales y pacientes con el objetivo de promover un uso adecuado de estos tratamientos.
El capítulo de información al paciente también se actualiza para adaptarse a la realidad digital, facilitando la disponibilidad de prospectos en formato electrónico y modernizando los requisitos de accesibilidad. Del mismo modo, se refuerza la protección del paciente mediante nuevas obligaciones en farmacovigilancia y en la gestión del ciclo de vida de los medicamentos.
Valoración por los ponentes
La ponente del Parlamento Europeo para la directiva, Dolors Montserrat, subrayó la importancia del acuerdo en una declaración distribuida por su equipo: “Este acuerdo es una gran noticia para todos los europeos, pues pone a los pacientes en el centro de la nueva legislación farmacéutica. Demostramos que la salud en una prioridad en la política europea”. Añadió que la nueva normativa contribuirá a que “los europeos tengan acceso a más y mejores tratamientos y a que la UE tenga un sector farmacéutico y sanitario fuerte capaz de proteger la salud de los europeos”.

Montserrat explicó que el Parlamento se ha centrado en “modernizar la regulación, incentivar la inversión en innovación y priorizar las necesidades médicas no cubiertas”, especialmente en ámbitos como las enfermedades raras o los cánceres pediátricos. Asimismo, destacó el “impulso a genéricos y biosimilares para reforzar la sostenibilidad de los sistemas sanitarios”.
A propósito de los antimicrobianos, incidió en que la resistencia bacteriana es “la gran amenaza para la salud pública”. Para ello, señaló que trabajó en fomentar la investigación de nuevos antibióticos y en asegurar “que sea siempre obligatoria la prescripción para dispensar antibióticos”. La nueva regulación incorporará también una tarjeta en los envases para advertir de la importancia de un uso adecuado. Montserrat apuntó además a la mejora de la información al paciente mediante un prospecto digital y a la defensa del papel de las farmacias y las fórmulas magistrales. “Estas y muchas más son las medidas que hemos aprobado esta madrugada en beneficio de los pacientes, que somos todos nosotros”, concluyó.
El presidente de la Comisión de Salud Pública del Parlamento (SANT), Adam Jarubas, subrayó la importancia de asegurar que la llegada de nuevos medicamentos se produzca en condiciones de equidad en toda la UE y sin retrasos prolongados. Según explicó, las diferencias actuales entre Estados miembros pueden superar los dos años y requieren mecanismos regulatorios que garanticen una competencia efectiva una vez finalicen las exclusividades. En sus palabras, “necesitamos nuevas terapias innovadoras para necesidades médicas no cubiertas (…) y medicamentos que podamos permitirnos”, y consideró que el acuerdo logrado “ha permitido alcanzar un equilibrio” para situar estos objetivos en el centro de la reforma.

Por su parte, el ponente del reglamento del paquete farmacéutico, Tiemo Wölken, puso el foco en la capacidad de la reforma para reforzar la resiliencia sanitaria europea ante desafíos como los desabastecimientos o la resistencia antimicrobiana. A su juicio, el texto pactado abre la puerta a una respuesta más robusta frente a crisis futuras y constituye “un hito significativo” en el avance hacia una atención sanitaria más justa y accesible para toda la ciudadanía europea. Wölken subrayó la importancia de que las medidas de acceso convivan con incentivos a la innovación orientada a necesidades médicas no cubiertas, que calificó como “partes fundamentales de esta reforma”, al tiempo que destacó el impacto que tendrá el nuevo marco en la capacidad de la UE para proteger de forma más efectiva la salud pública.
Un proceso legislativo complejo
El camino hacia el acuerdo no fue sencillo. La reforma farmacéutica forma parte de la Estrategia Farmacéutica para Europa presentada en 2020 y necesitó múltiples rondas de negociación para conciliar posiciones sobre incentivos, obligaciones de suministro y garantías de acceso equitativo. La Comisión presentó inicialmente el paquete legislativo en 2023 y el Parlamento y el Consejo han trabajado desde entonces en ajustar su alcance y sus implicaciones para los sistemas sanitarios nacionales.
Con este acuerdo provisional, la UE da un paso decisivo hacia la modernización de su marco regulatorio del medicamento, un texto que aspira a equilibrar innovación, acceso y sostenibilidad. Está previsto que la votación final se produzca en los próximos meses.


















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: